Now - 00:54:00
A característica de sódio. A fórmula de sódio
O Sódio — um dos metais alcalinos. Tabela de elementos químicos, mostra-o como um átomo que pertence ao terceiro período e o primeiro grupo.
Propriedades Físicas
Nesta seção será analisada a característica de sódio a partir do ponto de vista da física. Para começar, que na sua forma pura, é um sólido de cor prata, com brilho metálico e baixa dureza. O sódio é tão macio, que pode ser facilmente cortado com uma faca. A temperatura de fusão esta substância é muito baixa e é de setenta e nove graus Celsius. Massa atômica do sódio também é muito pequena, e sobre ela falaremos mais tarde. A densidade desse metal é igual a 0,97 g/cm3.
Caracterização Química de sódio
Este elemento tem elevada atividade — ele é capaz de rapidamente e reagir violentamente com muitas outras substâncias. Também a tabela de elementos químicos permite determinar este valor, como a massa molar — de sódio, ela é de vinte e três. Um mol — é a quantidade de substância que contém 6,02 x 10 23 grau de átomos (moléculas, se a substância complexa). Sabendo молярную a massa do elemento, pode-se determinar o quanto vai pesar um número específico de traça deste вещетсва. Por exemplo, dois mol de sódio pesa quarenta e seis gramas. Como já foi dito acima, este metal — um dos mais quimicamente ativos, ele se refere a um produto alcalino, respectivamente, o óxido pode formar um álcali (o forte da base).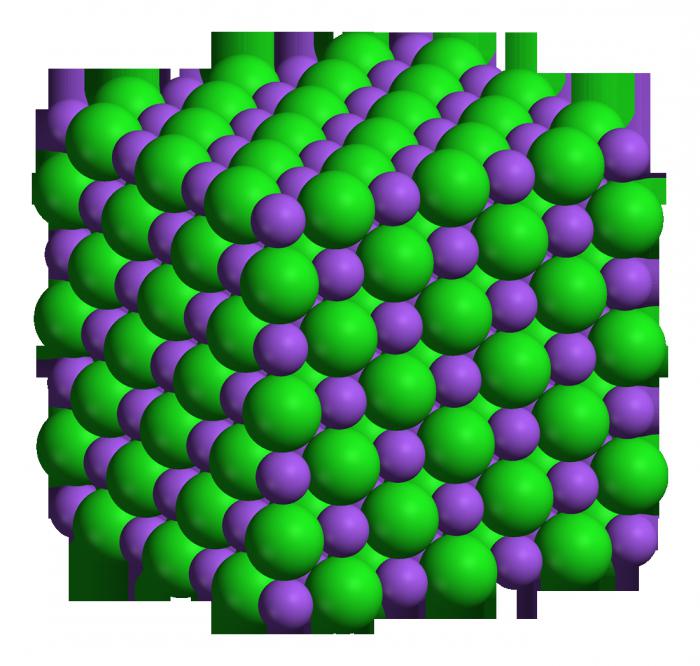
Como se formam óxidos
Todas as substâncias deste grupo, inclusive no caso do sódio, pode obter através da queima de origem. Por conseguinte, ocorre uma reação do metal com o oxigênio, que provoca a formação de óxido. Por exemplo, se queimar quatro mol de sódio, vai passar um mol de oxigênio, obtemos dois mol de óxido do metal. A fórmula de sódio óxido — Nd2O. a Equação da reação é: 4Na + De2 = 2Na2O. Se somarmos a substância obtida a água, formam um álcali — NaOH.
Mais:
A história do desenvolvimento da tecnologia de computação
Os primeiros dispositivos de computação foram os próprios dedos de uma pessoa. Quando a ferramenta foi suficiente, no curso de iam pedras, galhos, conchas. Dobrando-se de um conjunto de dezenas, depois centenas, o homem aprendeu a contar e usar as fe...
O impulso nervoso, a sua conversão e o mecanismo de transmissão
O sistema Nervoso humano atua como uma espécie de coordenador no nosso corpo. Ela passa o comando do cérebro musculatura, órgãos, tecidos e processa os sinais de longo alcance deles. Como uma espécie de suporte de dados, é usado o impulso nervoso. O ...
Canal do panamá: um ano, a abertura oficial do objecto e a sua importância histórica
Durante séculos, a humanidade tenta recriar condições naturais da Terra, com o objetivo de receber quaisquer benefícios. Um desses casos, a adaptação é do canal do Panamá, o ano, a abertura oficial deste objeto foi marcado por um evento, повлиявшим p...
Tendo um mol de óxido de água, obteremos dois mole de fundação. Eis a equação desta reação: Nd2O + H2 = 2NaOH. A substância resultante é ainda chamado de sódio é corrosivo. Isto é devido à sua brilhante pronunciada alcalinos propriedades e excelente resistência química активнотью. Como os ácidos fortes, pungente ativamente o sódio reage com os sais de малоактивных de metais, compostos orgânicos e т. д. Durante a interação com os sais, ocorre a reação de troca — é formado um novo sol e a nova base. A solução de hidróxido de sódio pode facilmente destruir o tecido, papel, pele, unhas, por isso ele requer o cumprimento de normas de segurança durante o trabalho com ele. Aplica-se o hidróxido de sódio na indústria química como um catalisador, e também na vida como ferramenta para a resolução de problemas засоренных tubos.
Reação com галогенами

Este É um simples de substâncias, compostos de elementos químicos, que se referem ao sétimo grupo da tabela periódica. Em sua lista entram flúor, iodo, cloro, bromo. O sódio é capaz de reagir com todos eles, formando uma ligação, como o cloreto de/metil/йодистый/fluoreto de sódio. Para realizar a reação precisa tomar dois mole em questão de metal, adicionar a ele um mol de flúor. O resultado é uma fluoreto de sódio na quantidade de dois mole. Este processo pode ser escrita como a equação: Na + F2 = 2NaF. Фтористий de sódio, que nós recebemos, é empregada na fabricação de pastas de dentes contra a cárie dentária, bem como detergente para uma variedade de superfícies. Da mesma forma, ao adicionar cloro pode obter cloreto de sódio (sal de cozinha), йодистый de sódio, que é utilizado na fabricação de lâmpadas de vapores metálicos, metil sódio, utilizado como uma droga quando неврозах, insônia, histeria e outros distúrbios do sistema nervoso.
Com outras substâncias simples
Também é possível reação do sódio com o fósforo, сульфуром (cinzenta), carbono (carbono). Esse tipo de químicos interação só pode ser no caso da criação de condições especiais na forma de alta temperatura. Por conseguinte, ocorre uma reação de adesão. Com sua ajuda você pode obter substâncias como o fosforeto de sódio, sulfeto de sódio, carboneto de sódio.
Como, por exemplo, a adesão de átomos do metal, os átomos de fósforo. Se tomar três mole em questão de metal e um mol de um segundo componente e, em seguida, aquecer-los, então temos um mol de fosforeto de sódio. Esta reação pode ser escrita como a seguinte equação: 3Na + P = Nd3P. Além disso, o sódio é capaz de reagir com o nitrogênio e o hidrogênio. No primeiro caso, é formado nitreto de um determinado metal, no segundo — hidreto. Como exemplos de tais equações de reações químicas: 6Na + N2 = 2Na3N; 2Na + H2 = 2NaH. Para realizar a primeira interação é necessária descarga elétrica, segundo — alta temperatura.
Reação com ácidos
Em substâncias simples caracterização química de sódio não termina. Este metal também reage com os ácidos. Como resultado destas interações químicas formado sal de sódio e hidrogênio. Por exemplo, quando a reação em questão de metais com ácido clorídrico formado sal de cozinha e o hidrogênio,que evapora. Para expressar esta reação pode ser usando a equação da reação: Na + HCl = NaCl + H2. Esse tipo de química a interação é chamada de reação de substituição. Com a ajuda de sua realização também é possível obter tais sal, como o fosfato, nitrato, nitrito, sulfato, sulfito, carbonato de sódio.
A Interação com os sais
O Sódio reage com os sais de todos os metais, além de potássio e de cálcio (eles possuem maior atividade química, do que o controle em questão). Em tal caso, como no anterior, ocorre uma reação de substituição. Os átomos do metal em questão tornam-se no lugar de átomos quimicamente mais fraco de metal. Assim, a mistura de dois mol de sódio e um mol de nitrato de magnésio, obtemos o nitrato de sódio na quantidade de duas a traça e puro magnésio — um mol. Escrever uma equação desta reação pode ser assim: 2Na + Mg(NO3)2 = 2NaNO3 + Magnésio. Pelo mesmo princípio, você pode obter e muitos outros sais de sódio. Também desta forma, você pode receber de metais a partir de seus sais.
O Que será, quando o sódio água
Este É, talvez, uma das substâncias mais comum no planeta. E com ele em questão de metal também é capaz de entrar em química a interação. Isso cria já considerado acima do acre, sódio ou hidróxido de sódio.
Para a realização de tal reação vai precisar tomar duas mol de sódio, adicionar-lhe água, também em número de dois a traça, e como resultado, obteremos dois mol de hidróxido e um mol de hidrogênio, que para se destacar como um gás com odor forte.
O Sódio e o seu impacto sobre os organismos
Considerando o metal com um ponto de vista químico, passar para o qual biológica característica de sódio. Ele é um dos mais importantes micronutrientes. Primeiro de tudo, ele é uma das que compõem a gaiola animal. Aqui, ele desempenha funções importantes: juntamente com o potássio mantém o potencial de membrana, está envolvido na formação e propagação de impulsos nervosos entre as células, é um elemento químico para осмотических de processos (o que você precisa, por exemplo, para o funcionamento de células renais). Além disso, o sódio é responsável pela dispersão de equilíbrio entre sal e água da pilha. Também sem um determinado elemento químico não é possível o transporte de glicose no sangue, necessária para o funcionamento do cérebro. Ainda este metal está envolvido no processo de redução de мыщц.
Este é um mineral necessário não só um animal — o sódio no organismo de plantas também desempenha funções importantes: ele está envolvido no processo de fotossíntese, ajudando a transportar os hidratos de carbono, e também é necessário para a passagem de compostos orgânicos e inorgânicos de substâncias através da membrana.
O Excesso e a falta de sódio
A um aumento do conteúdo de um determinado elemento químico no organismo pode levar ao consumo excessivo de sal ao longo de um longo período de tempo. Sintomas de excesso de sódio pode ser o aumento da temperatura do corpo, inchaço, aumento da excitabilidade nervosa, a violação do funcionamento dos rins. Em caso de surgimento de tais sintomas é preciso retirar da dieta e cozinha o sal e os produtos em que muitos deste metal (lista a seguir), depois de consultar o seu médico imediatamente. Baixo teor no corpo de sódio também resulta em sintomas desagradáveis e interrupções de órgãos. Vaza este elemento químico pode prolongado receber мочегонных de medicamentos ou pela ingestão de bebida só purificada (destilada) de água, ao aumento do потоотделении e desidratação do organismo. Sintomas de falta de sódio são o desejo, a secura da pele e das membranas mucosas, vômitos e náuseas, falta de apetite, alterações da consciência e apatia, taquicardia, rescisão de pleno direito do trabalho dos rins.
Os Produtos em que muitos de sódio
Para evitar a muito alta ou muito baixa conteúdo no corpo em questão elemento químico, terá de saber que tipo de alimento. Antes de tudo, é a já mencionada acima sal de cozinha. Ela quarenta por cento é composto de sódio. Também pode ser o sal do mar. Além disso, o metal contido em soja e a soja de molho. A grande quantidade de sódio pode ocorrer em frutos do mar. Esta é a marinha, a couve, a maioria das espécies de peixes, camarões, polvos, крабовое a carne, os ovos, os cancros e др. o Teor de sódio em um deles está relacionado com o fato de que os dados de organismos que vivem em água salgada e de um ambiente com alta concentração de sais de metais diferentes, importantes para o bom funcionamento do organismo.
O Uso deste metal e de alguns dos seus compostos
A Aplicação de sódio na indústria é muito versátil. Antes de tudo, esta substância usam na indústria química. Aqui é necessário para a obtenção de tais substâncias, como o hidróxido do metal em questão, o fluoreto, sulfatos e nitratos. Além disso, ele é usado como um forte agente de redução — para realçar o limpador de metais a partir de seus sais. Existe uma técnica de sódio, projetado para uso em tais fins. Suas propriedades são fixados em Pe 3273-75. Em conexão com os mencionados acima fortes propriedades redutoras sódio é amplamente utilizado na metalurgia.
Este elemento químico encontra a sua aplicação em фамацевтической indústria, onde, muitas vezes ele é necessário para obter-lo de brometo, que é um dos principais componentesmuitos sedativos e antidepressivos. Além disso, o sódio pode ser usado na fabricação de lâmpadas de descarga de gás — tais são as fontes de brilhante luz amarela. É um composto químico, como o clorato de sódio (NaClO3), destrói as plantas jovens, por isso ele é usado para a remoção de tal, com os caminhos-de-ferro para o aviso зарастания últimos. O cianeto de sódio é amplamente utilizado na indústria para a obtenção de ouro. Com a sua ajuda que recebem o metal das rochas.
Como são o sódio
A forma Mais comum é a reação do carbonato em questão de metal com o carbono. Para isso, é necessário aquecer o dos substância a uma temperatura de cerca de mil graus Centígrados. Em conseqüência disso, são formados dois desses químicos de conexão, como o sódio e o чадный gás. Durante a interação de um mol de carbonato de sódio com duas mole de carbono acontece duas mole desejado metal e três mol de monóxido de carbono. A equação da tabela de reação pode ser escrita como segue: NaCO3 + 2C = 2Na + 3СО. Da mesma forma, este elemento químico pode ser obtido a partir de outros compostos.
Qualidade de resposta
A Presença de sódio+, bem como de quaisquer outros cátions ou ânions, pode-se determinar, através de eventos especiais, manipulação de produtos químicos. A qualidade de uma reação íon sódio é a queima — em caso de presença de chama será pintado na cor amarela.
Onde se pode encontrar uma reportagem de um elemento químico na natureza
Em primeiro lugar, como já foi dito, ele é um dos componentes como animal e vegetal da pilha. Também alta concentração ocorre na água do mar. Além disso, o sódio entra na composição de alguns minerais. É, por exemplo, сильвинит, a sua fórmula — NaCl • KCl, bem como карналлит, a fórmula do qual KCl•MgCl2•6H2O. o Primeiro deles tem heterogênea estrutura de distribuição de peças coloridas, na sua pintura podem encontrar-se laranja, rosa, azul, vermelho. Este mineral é totalmente solúvel em água. Карналлит, dependendo da área específica de educação e de impurezas, também pode ter diferentes cores. Ele pode ser vermelho, amarelo, branco, em azul claro, transparente. Ele tem fraca brilho, os raios de luz nele fortemente преломляются. Estes dois minerais servem de matéria-prima para a obtenção de metais que entram em sua composição: sódio, potássio, magnésio.
Os Cientistas acreditam que o metal, que analisamos neste artigo, é um dos mais comuns na natureza, assim como o massa o seu quinhão na crosta da terra é de cerca de dois anos e meio por cento.
Article in other languages:
AR: https://tostpost.com/ar/education/15467-characteristics-of-sodium-the-formula-of-sodium.html
BE: https://tostpost.com/be/adukacyya/26684-haraktarystyka-natryyu-formula-natryyu.html
DE: https://tostpost.com/de/bildung/26353-eigenschaft-des-natriums-formel-natrium.html
En: https://tostpost.com/education/26040-characteristics-of-sodium-the-formula-of-sodium.html
ES: https://tostpost.com/es/la-educaci-n/26240-caracter-stica-de-sodio-la-f-rmula-de-sodio.html
HI: https://tostpost.com/hi/education/15186-characteristics-of-sodium-the-formula-of-sodium.html
JA: https://tostpost.com/ja/education/15135-characteristics-of-sodium-the-formula-of-sodium.html
KK: https://tostpost.com/kk/b-l-m/26984-sipattamasy-natriy-formulasy-natriy.html
PL: https://tostpost.com/pl/edukacja/28052-charakterystyka-sodu-formu-a-sodu.html
TR: https://tostpost.com/tr/e-itim/26898-zelli-i-sodyum-form-l-sodyum.html
UK: https://tostpost.com/uk/osv-ta/27255-harakteristika-natr-yu-formula-natr-yu.html
ZH: https://tostpost.com/zh/education/10139-characteristics-of-sodium-the-formula-of-sodium.html

Alin Trodden - autor do artigo, editor
"Olá, sou o Alin Trodden. Escrevo textos, leio livros e procuro impressões. E eu não sou ruim em falar sobre isso. Estou sempre feliz em participar de projetos interessantes."
Notícias Relacionadas
Problemas de lógica para crianças de 6-7 anos com respostas
problemas de Lógica para crianças de 6-7 anos de idade para ajudar a cultivar a mentalidade certa para formar o interesse matemático educação em idade pré-escolar.características Etáriasesta É a mais jovem idade pré-escolar estabe...
Problemas de lógica para crianças de 6-7 anos com respostas
problemas de Lógica para crianças de 6-7 anos de idade para ajudar a cultivar a mentalidade certa para formar o interesse matemático educação em idade pré-escolar.características Etáriasesta É a mais jovem idade pré-escolar estabe...
A Ampola De Edison. Quem inventou a primeira lâmpada? Por isso, toda a glória foi para o Эдисону?
A lâmpada incandescente, que é usado em praticamente todos os lares, muitas vezes referida como a lâmpada de Edison. A história de sua invenção não foi tão simples assim. Antes de dar a luz artificial bilhões de pessoas, ela perco...
A proteína do leite e a hidrólise de proteínas
a Proteína – é uma substância química que é o composto orgânico высокомолекулярного tipo. Na composição de proteínas, existem mais de uma centena de resíduos de diferentes aminoácidos. Cada pessoa no seu corpo, deve co...
Divisão celular: descrição dos principais processos de
Divisão celular — é um processo natural, que assegura o crescimento normal, desenvolvimento e reprodução do organismo. Devido a isso, aumenta o número de células é realizada crescimento dos tecidos, a reprodução sexual e a t...
a Rússia no século 17, média, interna sociais da crise e polonês sueco intervenção, foi forçado a viver com suas perdas territoriais: Yayi, Копорье, Ивангород, bem como Smolensk, черниговские da terra se retiraram a seus vizinhos ...






















Comentários (0)
Este artigo possui nenhum comentário, seja o primeiro!