Now - 05:22:48
Halojenler: fiziksel özellikleri, kimyasal özellikleri. Uygulama halojenler ve bileşikleri
Halojenler periyodik tabloda yer alan sol gazlar. Bu beş toksik metalik olmayan öğeleri içeren 7 grup periyodik tablo. Bunlar, flor, klor, brom, iyot ve астат. Olsa астат radyoaktif ve sadece kısa ömürlü izotoplar davranır gibi, iyot, ve sık sık bu rütbe галогенам. Çünkü halojen elemanları var yedi değerlik elektronları, onlara gerekli olan sadece bir ekstra elektron eğitim için tam bir sekizli. Bu özellik onları daha aktif, daha diğer grubu ametal.
Genel özellikler
Halojenler oluştururlar двухатомные moleküller (tip X2, X gösterir atom halojen) – istikrarlı forma varlığı halojen olarak boş öğeleri. İletişim bu двухатомных molekül nonpolar, ковалентными ve tek. Kimyasal özellikleri halojenler izin kolayca katılmak için bağlantı çoğu öğeleri, bu yüzden onlar karşılamak asla ayrık olarak doğada. Flor – en aktif halojen ve астат – az.
Tüm halojenler tuz oluştururlar I grubu ile benzer özelliklere sahip. Bu bağlantıları halojenler mevcut olarak halide anyon yükü ile -1 (örneğin, Cl-, Br-). Bitiş-bayram olduğunu gösterir halide-anyon; örneğin Cl- denilen «klorür».
Ayrıca, kimyasal özellikleri, halojenler izin olarak hareket oksidan – okside metaller. Çoğu kimyasal reaksiyonlar, dahil halojenler – redoks sulu çözelti içinde. Halojenler oluşturacak tek bir bağlantı ile bir karbon veya azot ile organik bağlantıları olduğu ölçüde onları oksidasyon (İLE) eşittir -1. Ne zaman bir halojen atomu ikame kovalent-uzantılı dosya hidrojen atomu, organik bir bağlantı öneki halo kullanılabilir genel anlamda, ya da önekler flor, klor, brom - iyot- – belirli çıkarır. Halojen öğeleri olabilir çapraz bağ oluşumu ile двухатомных moleküllerin kutup ковалентными tek bağlantıları.
Daha:
Sinir impuls, onu dönüştürme ve aktarım mekanizması
Sinir sistemi savunan bir tür koordinatörü vücudumuzda. O komutları iletir beyin мускулатуре, organlara, dokulara ve işler sinyalleri gidiyor onlara. Tür olarak veri taşıyıcı tarafından kullanılan bir sinir dürtü. Neyi temsil ettiğini? Hangi hızda ça...
Isıl işlem çelik yapılabilir çeşitli yolları vardır. Uzmanlar ayırt aşağıdaki seçenekleri sunar: 1. Ateş. 2. Normalleştirme. 3. Sertleşme olduğunu. 4. Tatil. Isıl işlem çelik kızartma temsil ısıtma ürün sıcaklık 840 900 derece. Sırasında belirtilen s...
Ana tür duyumlar: sınıflandırma, özellikleri
Psikoloji – bu çalışmalar bilim farklı zihinsel süreçler, olaylar ve durum. Bu bilgilendirici zihinsel süreçleri içerir hissi, görünüm, algı, hayal gücü, konuşma, düşünme, ezberleme, dinleme, kaydetme, vb. bu makalede, biz daha duralım böyle bi...
Klor (Cl2) ilk haline галогеном, açık 1774 yılında, daha sonra açılmış olan iyot (I2), brom (Br2), flor (F2) ve астат (At, tespit son, 1940). Adı «halojen» geliyor yunan kökleri hal- («tuz») ve -gen («form»). Birlikte, bu sözcüklerin ne anlama geldiğini «солеобразующий» vurgulayarak, gerçeği, halojenler, yapan, ile reaksiyona metallerle tuz oluştururlar. Halit – bu paket kaya tuzu, doğal mineral, oluşan sodyum klorür (NaCl). Ve son olarak, halojenler kullanılır evde – florür içeren diş macunu, klor dezenfekte içme suyu ve iyot teşvik işçiliği tiroid hormonları.
Kimyasal elementler
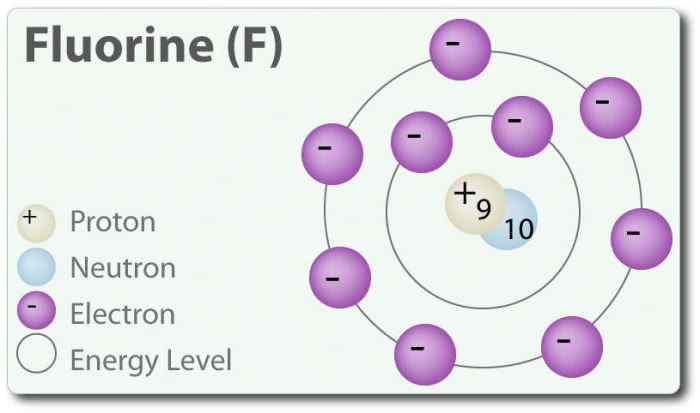
Flor – öğesi ile atom numarası 9, simgesi ile gösterilir F. Elementel flor ilk defa keşfedildi 1886 yılında ayırarak onu hidroflorik asit. Devlet özgür flor olarak var двухатомной moleküller (F2) ve en yaygın галогеном yerkabuğunun. Flor – en электроотрицательный element periyodik tablo. Oda sıcaklığında bir soluk sarı gaz. Flor de nispeten küçük atom yarıçapı. Onun – -1 hariç, ilköğretim двухатомного durum, bir oksidasyon derecesi sıfırdır. Flor son derece kimyasal olarak aktif ve doğrudan etkileşim tüm öğeleri hariç, helyum (He), neon (Ne) ve argon (Ar). Çözelti içinde H2O, hidroflorik asit (HF) zayıf bir asit. Olsa flor ağır электроотрицателен, onun elektronegatiflik tanımlar asit; HF zayıf bir asit olması nedeniyle florür iyon birincil (ph> 7). Ayrıca, flor üreten çok güçlü oksitleyiciler. Örneğin, flor ile reaksiyona girebilir, inert gaz xenon oluşturur, güçlü bir oksitleyici ajan дифторид xenon (XeF2). Ben florür çok kullanır.
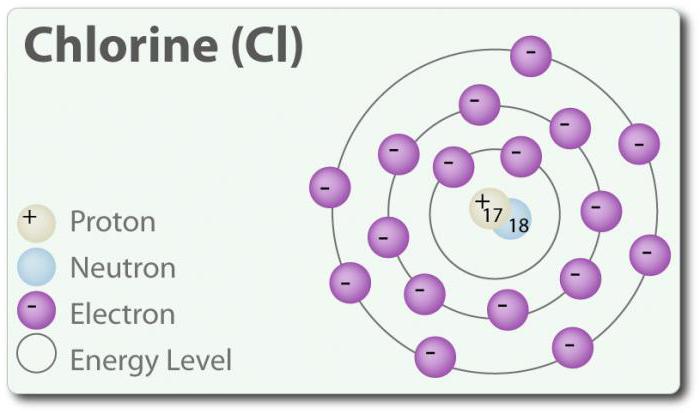
Klor – öğesi ile atom numarası 17 ve kimyasal sembolü Cl. Tespit 1774 yılında ayırarak onu hidroklorik asit. Onun ilköğretim durumu oluşturur двухатомную molekül Cl2. Klor vardır EDİLİR: -1, +1, 3, 5 ve 7. Oda sıcaklığında o açık yeşil gaz. Yani nasıl bir bağ oluşan iki arasında atomları klor, zayıf, molekül Cl2 sahip çok yüksek kapasiteli katılmak için bağlantı. Klor ile reaksiyona metaller ile tuzların oluşumu denir klorür. İyonlar klor en yaygın iyonları, onlar, bakın, deniz, su. Klor aynı zamanda iki izotop: 35Cl 37Cl. Sodyum klorür, en yaygın bağlantı tüm klorür.
Br – kimyasal element atom numarası 35 ve sembolü Br. İlk kez keşfedildi 1826 yılında ilköğretim formda brom, двухатомной molekül Br2. Oda sıcaklığında temsil kırmızımsı-kahverengi sıvı. Onun – -1, + 1, 3, 4 ve 5. Brom, daha aktif iyot, ama daha az aktif, klor. Ayrıca, brom, iki izotop: 79Vg ve 81Vg. Brom bulunur şeklinde bromür tuzları, çözünmüş deniz suyu. Son yıllarda üretim bromür dünyada önemli ölçüde artış sayesinde kullanılabilirlik ve uzun süreli yaşam süresi. Diğer halojenler, brombir oksidan ve çok toksiktir.
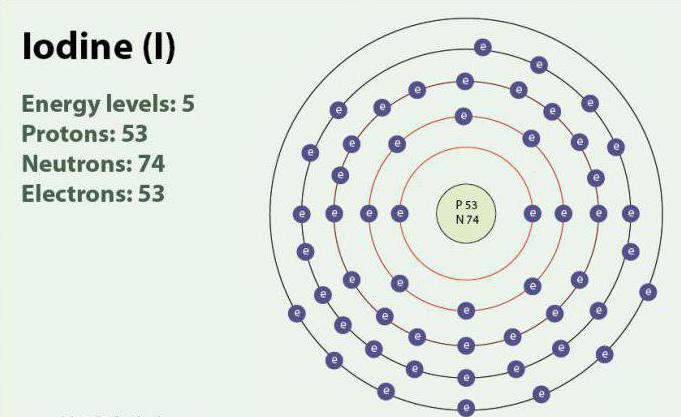
İyot – kimyasal element, atom numarası 53 ve sembolü I. İyot vardır oksidasyon derecesi: -1, +1, +5 ve +7. Olarak var двухатомной molekülleri, I2. Oda sıcaklığında bir katı madde mor renk. İyot vardır bir kararlı izotop - 127I. İlk kez tespit 1811 kullanarak deniz yosunu ve sülfürik asit. Şu anda iyonları iyot vurgulanabilir deniz suyu. Olmasına rağmen, iyot, çok iyi suda çözünür, onun çözünürlük artabilir kullanırken ayrı йодидов. İyot vücutta önemli bir rol oynar katılarak işçiliği tiroid hormonları.
Астат – bir radyoaktif element, atom numarası 85 ve sembolü At. Olası ölçüde oksidasyon: -1, +1, 3, 5 ve 7. Tek halojen olmayan двухатомной molekül. Normal koşullar altında bir metal katı madde siyah renk. Астат, çok nadir görülen bir unsur, bu nedenle, onun hakkında bilinen biraz. Ayrıca, астат çok kısa yarılanma ömrü, birkaç saat daha fazla. Elde edilen 1940 yılında çıkan bir sentez. İnanıyorum астат benzer iyot. Farklı metal özellikleri.
Aşağıdaki tabloda gösterildiği yapı halojen atomları, yapısı dış katman elektron.
Halo | Yapılandırma elektron |
Flor | 1s2 2s2 2p5 |
Klor | 3s2 35 |
Br | 3d10 4s2 4p5 |
İyot | 4d10 5s2 5p5 |
Астат | 4f14 5d10 6s2 6p5 |
Benzer bir yapısı dış katman elektron nedenle ne fiziksel ve kimyasal özellikleri halojenler benzer. Bununla birlikte, eşleme sırasında bu öğeleri gözlenen farklılıklar.
Periyodik özellikleri grup halojensiz
Fiziksel özellik basit maddeler halojen değiştirildi artan sıra numarası madde. Daha iyi emilimi için ve daha fazla görünürlük biz size bir kaç tablo.
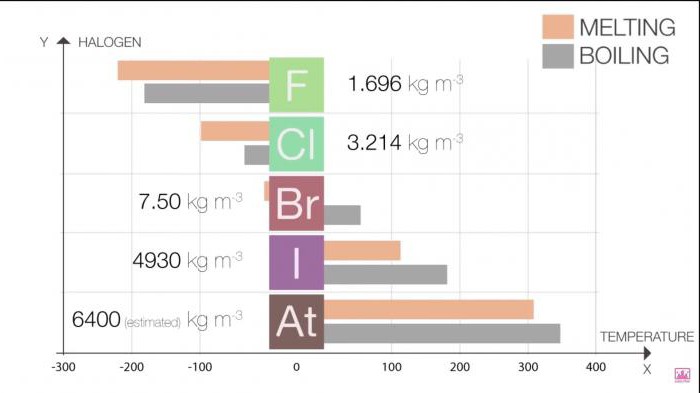
Erime Noktası ve kaynama grubunda artıyor arttıkça, molekül boyutu (F <Cl <Br <İ <At). Bu artış, artan gelir, kuvvet Van der Waals kuvvetleri.
Tablo 1. Halojenler. Fiziksel özellikler: erime noktası ve kaynama noktası
Halo | T erime noktası (C) | T kaynama noktası (C) |
Flor | -220 | -188 |
Klor | -101 | -35 |
Br | -7.2 | 58.8 |
İyot | 114 | 184 |
Астат | 302 | 337 |
- Atom yarıçapı artar.
çekirdek Boyutu artar (F < Cl < Br < İ < At) gibi giderek artan sayıda proton ve nötron. Ayrıca, her bir dönem eklenir, daha fazla enerji düzeyleri. Bu yol, büyük bir titreşimli zımpara, ve, bu nedenle, artan atom yarıçapı.
Tablo 2. Halojenler. Fiziksel özellikleri: atom yarıçapları
Halo | Ковалентный yarıçapı (pm) | İyon (X-) yarıçap (pm) |
Flor | 71 | 133 |
Klor | 99 | 181 |
Br | 114 | 196 |
İyot | 133 | 220 |
Астат | 150 |
- Iyonlaşma Enerjisi azalır.
Eğer dış валентные elektronlar değil, yakın çekirdek, o zaman bunları kaldırmak için ondan çok fazla enerji gerektirir. Bu nedenle, gerekli olan enerji miktarını sınırlandırmak için dış elektron kadar yüksek değil alt grup elemanları gibi, burada daha fazla enerji seviyeleri. Buna ek olarak, yüksek iyonlaşma enerjisi yapar eleman egzersiz metalik olmayan kalite. İyot ve ekran астат gösteren metal özellikleri, çünkü iyonlaşma enerjisi azalır (At < İ < Br < Cl < F).
Tablo 3. Halojenler. Fiziksel özellikleri: iyonlaşma enerjisi
Halo | Iyonlaşma Enerjisi (kj/mol) |
Flor | 1681 |
Klor | 1251 |
Br | 1140 |
Iyot | 1008 |
астат | 890±40 |
- Elektronegatiflik azalır.
Sayısı, değerlik elektron atomu ile artış enerji düzeyleri için zaman giderek daha düşük seviyelerde. Elektronlar giderek daha fazla çekirdek; Bu nedenle, çekirdek ve elektronlar olarak değil çektibirbirlerine. Artan koruyucu görülmektedir. Bu nedenle, Elektronegatiflik azalır büyüme dönemi (At < İ < Br < Cl < F).
Tablo 4. Halojenler. Fiziksel özellikleri: elektronegatiflik
Halo | Elektronegatiflik |
Flor | 4.0 |
Klor | 3.0 |
Br | 2.8 |
Iyot | 2.5 |
астат | 2.2 |
- Bir Yakınlık электрону azalır.
Boyutu atomun artar artış ile dönem, bir yakınlık электрону genellikle azalır (< İ < Br < F < Cl). İstisna – flor, yakınlık, kimin daha az klor. Bunu açıklamak için daha küçük boyutlu flor, klor ile karşılaştırıldığında.
Tablo 5. İlgi halojen içermeyen bu электрону
Halo | Bir Yakınlık электрону (kj/mol) |
Flor | < -328.0 |
Klor | -349.0 |
Br | -324.6 |
Iyot | -295.2 |
астат | -270.1 |
- Reaktivite öğeleri azalır.
Tepkime halojen düşen büyüme dönemi (At <İ <Br <Cl <F). Bunun nedeni, artan atom yarıçapı ile artan enerji düzeyleri, elektron. Bu azaltır cazibe valans elektronlar diğer atomların azaltarak, reaksiyon yeteneği. Bu düşüş de düşüş nedeniyle oluşur электроотрицательности artış dönem, ne de azaltır cazibe elektron. Ayrıca, artan boyutu ile atom azalır ve окислительная yeteneği.
İnorganik kimya. Hidrojen + halojenler
Halojenür oluşur halojen ile reaksiyona girer, diğer, daha az электроотрицательным bir öğe oluşturmak için bir ikili bağlantı. Hidrojen ile reaksiyona halojenler oluşturan halojenürler tür HX:
- фтороводород HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводород Hİ.
Hidrojen Halojenürler, kolayca suda çözülür oluşumu ile галогенводородной (hidroflorik, hidroklorik, бромистоводородной, иодистоводородной) asit. Özellikleri bu asitler aşağıda verilmiştir.
Asit oluşur, bir sonraki tepki: HX (aq) + H2O (l) → X- (aq) + H3O+ (aq).
Tüm галоидоводороды oluşturmak için güçlü asit hariç HF.
Asit галогеноводородных asitleri artar: HF <HCl <HBr <Hİ.
Hidroflorik asit yetenekli oyma cam ve bazı inorganik florür uzun bir süre.
Counterintuitive görünebilir, ne HF en zayıf галогенводородной asit gibi flor sahip en yüksek электроотрицательностью. Ancak iletişim, N-F, çok güçlü, neden asit çok zayıf. Güçlü bir bağlantı tanımlanır kısa uzunluğu nedeniyle ve büyük bir enerji oluşturur. Tüm hidrojen halojenürler HF en kısa uzunluğu nedeniyle ve en büyük enerji ayrışma nedeniyle.
Halojen оксокислоты
Halojen оксокислоты temsil asit atomları ile hidrojen, oksijen ve halojen. Onları asit ile tespit edilebilir yapı analizi. Halojen оксокислоты aşağıda verilmiştir:
- Хлорноватистая asit HOCl.
- Хлористая asit, HClO2.
- Хлорноватая asit, HClO3.
- Perklorik asit, HClO4.
- Бромноватистая asit HOBr.
- Бромноватая asit HBrO3.
- Бромная asit HBrO4.
- Иодноватистая asit HOİ.
- Йодноватая asit HİO3.
- Метайодная asit HİO4, H5İO6.
Her biri bu asitler proton ile bağlı bir oksijen atomu, bu nedenle karşılaştırma uzunlukları bağları proton burada işe yaramaz. Baskın bir rol oynar elektronegatiflik. Aktif alkali sayısı ile artar, oksijen atomları ile ilgili, merkezi bir atom.
Görünüm ve maddenin durumu
Temel fiziksel özellikleri, halojenler kısaca ifade aşağıdaki tabloda gösterilmiştir.
Durum madde (oda sıcaklığında) | Halo | Görünüm |
Sağlam | Iyot | Mor |
астат | Siyah | |
Sıvı | Br | Kırmızı-kahverengi |
Gaz | Flor | Soluk sarı-kahverengi |
Klor | Açık yeşil |
Açıklama görünüm
Renk halojen sonucudur emme, görünür ışık molekülleri neden uyarma, elektron. Flor emer mor ışık, ve, bu nedenle, görünüyor, açık sarı. İyot, tam tersi, emer sarı ışık görünüyor mor (sarı ve mor – tamamlayıcı renkler). Renk halojen koyulaşır artan bir süre.
Kapalı kaplarda sıvı brom ve katı iyot dengesi ile çiftler görülebilir şeklinde renkli gaz.
Rengi Olsa астата bilinmiyor, varsayalım, o-meli var olmak daha koyu iyot (yani siyah) uygun olarak gözlenen düzenlilik.
Şimdi, eğer istenir: «Охарактеризуйте fiziksel özellikleri halojenler» ecek söylemek.
Oksidasyon Derecesi halojen bağlantılar
Oksidasyon Derecesi genellikle yerine kullanılan kavramlar "değerlik atlayabilirsiniz halojen". Genellikle, oksidasyon derecesi eşittir -1. Ama eğer halojen ile bağlantılı, oksijen veya başka bir галогеном, o alabilir diğer durum: OK oksijen -2 önceliği vardır. Bu durumda iki farklı atomları halojen, amerika birleşik birlikte, daha электроотрицательный atom hakim ve alır -1.
Örneğin, klorür, iyot (Icl) klor İLE -1 ve iyot +1. Klor daha электроотрицательным daha iyot, bu yüzden onun İLE eşittir -1.
бромной asit (HBrO4) oksijen vardır İLE -8 (-2 x 4 atom = -8). Hidrojen genel bir oksidasyon derecesi +1. Toplama, bu değerleri verir İLE -7. Çünkü sonlu İLE bağlantısı olmalı sıfır, sonra brom eşit +7.
Üçüncü kuralın dışında bir oksidasyon derecesi halojen ilköğretim formu (X2), onun İLE eşittir sıfır.
Halo | İLE bağlantılar |
Flor | -1 |
Klor | -1, +1, +3, +5, +7 |
Br | -1, +1, +3, +4, +5 |
Iyot | -1, +1, +5, +7 |
астат | -1, +1, +3, +5, +7 |
Neden flor her zaman -1?
Elektronegatiflik artar büyüme dönemi. Bu nedenle flor en yüksek elektronegatiflik tüm öğeleri tarafından desteklenen yerini periyodik tabloda. Onun elektron dizilişi 1s2 2s2 2p5. Eğer flor alır başka bir elektron, aşırı p-orbital tam dolu ve makyaj tam bir sekizli. Çünkü florür yüksek elektronegatiflik, kolayca seçmek elektron var komşu atom. Flor bu durumda изоэлектронен инертному gazze (sekiz валентными elektron), tüm dış orbital dolu. Bu durumda flor çok daha kararlı.
Alma ve uygulama halojensiz
Doğada halojenler durumda bulunan anyon, bu nedenle boş halojenler olsun yöntemi, oksidasyon, elektroliz ile veya oksidanlar. Örneğin, klor üretilen, hidroliz çözeltisi tuz. Uygulama halojenler ve bileşikleri çeşitli.
- Flor. Olmasına rağmen, flor çok реактивен, o birçok alanda kullanılan sanayi. Örneğin, bu anahtar bileşenleri politetrafloroetilen (teflon) ve diğer bazı фторполимеров. Хлорфторуглероды temsil, organik kimyasal maddeler, daha önce olarak kullanılan soğutucu akışkan ve пропеллентов aerosoller. Uygulama durdu olası çevre etkilerini. Onların yerine гидрохлорфторуглероды. Florür eklenir, diş macunu (SnF2) ve içme suyu (NaF) önlemek için kırık diş. Bu halojen içeren kil üretimi için kullanılan bazı türler seramik (Lıf), kullanılan nükleer enerji (UF6), elde etmek için antibiyotik фторхинолона, alüminyum (Na3AlF6), yalıtım için yüksek gerilim ekipmanları (SF6).
- Klor de buldum zengin bir uygulama. O için kullanılan dezenfeksiyon, içme suyu ve yüzme havuzları. Sodyum hipoklorit, (NaClO) bir ana bileşeni tribün. Hidroklorik asit yaygın olarak kullanılan sanayi ve laboratuvarlarda. Klor mevcut поливинилхлориде (PVC) ve diğer polimerler için kullanılan, yalıtım, kablolama, borular ve elektronik. Ayrıca, klor yararlı oldu ve ilaç endüstrisi. İlaçlar, klor içeren, tedavi etmek için kullanılır enfeksiyonlar, alerji ve diyabet. Tarafsız formu hidroklorür – bileşen birçok ilaç. Klor için de kullanılır sterilizasyon hastane ekipmanları ve dezenfeksiyon. Tarımda klor bileşenidir birçok ticari pestisit: DDT (дихлородифенилтрихлорэтан) olarak kullanılan tarımsal böcek ilacı, ancak kullanımı sonlandırıldı.

- Br sayesinde негорючести uygulanan bastırmak için yanan. Ayrıca kavrami, бромистом метиле, pestisit kullanılması daha uygun olacaktır depolamak için kullanılan hasat ve bastırma bakteri. Ancak aşırı kullanımı, metil bromür nedeniyle iptal edildi onun etkisi ozon tabakası. Brom kullanılan, üretiminde, benzin, film, yangın söndürücüler, ilaç tedavisi için, zatürre ve Alzheimer hastalığı.
- İyot önemli bir rol oynar ve düzgün işleyişinde tiroid. Eğer vücut alır, yeterli miktarda iyot, artış, tiroid. Önlenmesi için guatr bu halojen eklenir tuzu. İyot olarak da kullanılır antiseptik ilaçlar. İyot içeren çözümleri için kullanılantemizleme açık yaralar, yanı sıra dezenfektan спреях. Ayrıca, gümüş iyodür önemlidir fotoğraf.
- Астат – radyoaktif ve редкоземельный halojen, bu nedenle başka hiçbir yerde kullanılmaz. Ancak inanıyorum ki bu öğe için yardımcı olabilir iyot düzenlenmesinde tiroid hormonları.
Article in other languages:

Alin Trodden - makalenin yazarı, editör
"Merhaba, ben Alin Trodden. Metin, kitap okumak, yazmak ve Gösterimler için bak. Ve sana söylüyorum.kötü değilim. İlginç projelere katılmaktan her zaman mutluluk duyarım."
İlgili Haberler
Biyografi Mireille Mathieu – meşhur yıldızları fransız şarkıcı
Büyük fransız sanatçı chanson Mireille Mathieu doğdu Avignon, 22 temmuz 1946 aile yoksul taşçı. Var Mireille zor bir çocukluk geçirdim. O eski çocuk büyük bir aile (buna Mireille aile daha vardı 15 çocuk: 14 erkek ve 1 kız kardeşi...
Yönetim Kurulu Aleksey Mihayloviç Тишайшего. Emir Gizli işler
Kurum, emir Gizli işler (yıl oluşumu yaklaşık 1653-cü) başlatılan Alexei Михайловичем Тишайшим incelemektedir iki gol. Bir yandan, o kullanılan özel ofisi egemen. Başka bir emri Gizli işler savundu rolü devlet organı, ana bilgisay...
Nedir insani bir felaket? Tanımı ve örnekler
Dünya haberleri zaman zaman söylüyorum, olaylar hakkında en yoksul ülkelerde gezegen (Ruanda, Kamboçya, Somali), tüketilen terim «insani bir felaket». İzleyicinin hayal çizer kasvetli bir resim, подкрепляемую belgesel ...
Kaptan - bu rütbe kazak ordusunda
Kaptan – bu rütbe kazak ordusunda. Önce çok именовался yardımcısı savaş ağası, daha sonra есаула çelik eşit ротмистру ya da kaptan. Ne demek bu kelime?Etimoloji kelimelertek sürümü, "kaptan" – bu kelime türk kökenli. B...
Tanya üçüncü bölüm: biyografi, блокадный günlüğü ve ilginç gerçekler
Düz leningradskaya kız Tanya üçüncü bölüm, olarak bilinen haline gelmiştir, tüm dünya sayesinde bir günlüğüne, bir o led 1941 – 1942 yılları sırasında Leningrad abluka. Bu kitapçık haline karakterlerden biri bu korkunç bir o...
Suyun rengi. Tanımı, özellikleri, su
Tüm teorisi hayatın ortaya Yeryüzünde bağlantılı bir şekilde su ile. O sürekli bizi yanında, ayrıca, içimizde. En sıradan, basit bir su dahil vücut dokuları mümkün kılan her yeni bir nefes ve kalp atışı. Tüm bu süreçlerde ilgilenm...





















Yorumlar (0)
Bu makalede Yorum yok, ilk olmak!