Now - 18:55:39
Halogênios: propriedades físicas, propriedades químicas. Aplicação livre de halogênio e de suas conexões
Halogênios na tabela periódica, estão situados à esquerda dos gases nobres. Estes cinco tóxicos não-metálicos de elementos incluídos no grupo 7 da tabela periódica. Estes incluem flúor, cloro, bromo, iodo e астат. Embora астат radioativo e tem apenas isótopos de curta duração, ele se comporta como o iodo, e é freqüentemente classificado entre a галогенам. Porque os elementos halogênios têm sete elétrons de valência, eles precisam de apenas um elétron para a formação integral do octeto. Esta característica torna-os mais ativos do que outros grupos de неметаллов.
Características Gerais
Halogênios formam двухатомные molécula (tipo X2, onde X representa um átomo de halogênio) – forma estável a existência de halogéneo, na forma de entradas livres. A conexão desses di-moléculas são неполярными, ковалентными e único. Propriedades químicas de halogênio lhes permitem facilmente entrar em conexão com a maioria dos elementos, portanto, eles nunca se encontram em несвязанном como na natureza. O flúor ã o mais ativo de halogênio, e астат ã o menos.
Todos os halogênios formam o sal I grupos com propriedades semelhantes. Nestes compostos de halogênios estão presentes na forma de ânion haleto com carga -1 (por exemplo, Cl Br). Concluir -id indica a presença de галогенид-ânions; por exemplo, Cl chamado de ão cloreto de".
Além disso, as propriedades químicas dos halogênios lhes permitem agir como agentes oxidantes – oxidação de metais. A maioria das reacções químicas em que participam halogênios – redox em solução aquosa. Halogênios formam aspas simples de comunicação com o carbono ou nitrogênio em compostos orgânicos compostos, onde o seu grau de oxidação (COM) é igual a -1. Quando um átomo de halogênio substituído covalently-associado átomo de hidrogênio na orgânico ligação, o prefixo halo - pode ser usado em sentido geral, ou prefixos de flúor-, cloro, bromo- , iodo- – para o específico, livre de halogênio. Os elementos halogênios podem ter uma relação com a formação de di-moléculas polares com ковалентными único associações.
Mais:
A história do desenvolvimento da tecnologia de computação
Os primeiros dispositivos de computação foram os próprios dedos de uma pessoa. Quando a ferramenta foi suficiente, no curso de iam pedras, galhos, conchas. Dobrando-se de um conjunto de dezenas, depois centenas, o homem aprendeu a contar e usar as fe...
O impulso nervoso, a sua conversão e o mecanismo de transmissão
O sistema Nervoso humano atua como uma espécie de coordenador no nosso corpo. Ela passa o comando do cérebro musculatura, órgãos, tecidos e processa os sinais de longo alcance deles. Como uma espécie de suporte de dados, é usado o impulso nervoso. O ...
Canal do panamá: um ano, a abertura oficial do objecto e a sua importância histórica
Durante séculos, a humanidade tenta recriar condições naturais da Terra, com o objetivo de receber quaisquer benefícios. Um desses casos, a adaptação é do canal do Panamá, o ano, a abertura oficial deste objeto foi marcado por um evento, повлиявшим p...
O Cloro (Cl2) tornou-se o primeiro галогеном, aberto em 1774 г. e, em seguida, foram abertos iodo (I2), bromo (Br2), flúor (F2) e астат (At, detectado por último, na década de 1940, г.). O nome "halogênio» vem de raízes gregas hal- ("g") e -genão de formar uma"). Juntas, essas palavras significam ão солеобразующий", destacando o fato de que halogênios, entram em reação com metais, formam o sal. Галит – é o nome de sal de rocha, natural do mineral, composto por cloreto de sódio (NaCl). E, finalmente, halogênios são usados em casa – o flúor contido na pasta de dente, cloro desinfeta a água potável, e de iodo contribui para a elaboração de hormônios da tireóide.
Elementos Químicos
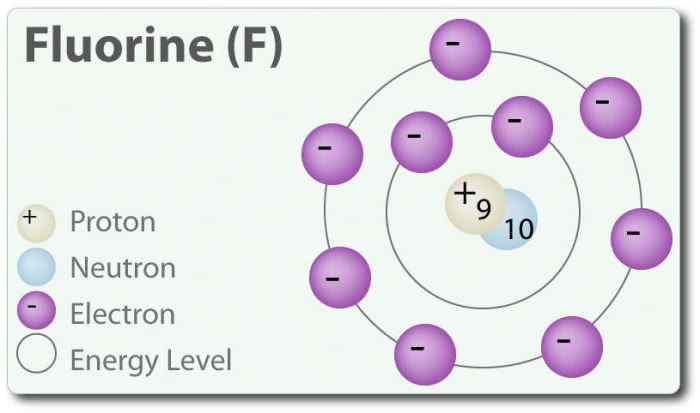
O Flúor – o elemento com número atômico 9, indicado por um símbolo de F. Elementar flúor foi encontrado pela primeira vez em 1886 г. através da atribuição de ácido fluorídrico. Um estado livre de flúor existe na forma de двухатомной molécula (F2) e é o mais comum галогеном na crosta da terra. O flúor – o mais электроотрицательный elemento na tabela periódica. Quando a temperatura ambiente é pálido amarelo gás. O flúor é relativamente pequeno raio atômico. COM – -1, exceto elementar diatomic estado no qual o seu grau de oxidação igual a zero. O flúor é extremamente quimicamente ativa que interage diretamente com todos os elementos, exceto o hélio (He), néon (Ne) e argônio (Ar). Em solução de H2O, ácido fluorídrico (HF) é um ácido fraco. Embora o flúor fortemente электроотрицателен, sua electronegatividade dos não determina a acidez; HF é um ácido fraco devido ao fato de que o íon flúor básico (ph> 7). Além disso, o flúor produz muito poderosos oxidantes. Por exemplo, o flúor pode reagir com o gás inerte xénon e que constitui um forte agente oxidante дифторид de xénon (XeF2). Você flúor muitas aplicações.
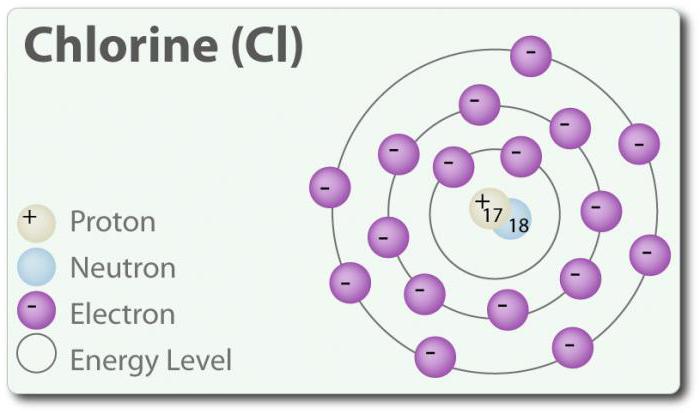
O – o elemento com número atômico 17 e o símbolo químico Cl. Descoberto em 1774 г. através da atribuição de ácido clorídrico. No seu mais básico capaz de formar двухатомную molécula Cl2. O cloro tem vários COM: -1, +1, 3, 5 e 7. À temperatura ambiente, ele é a luz-gás verde. Assim como a comunicação, que é formado entre os dois átomos de cloro, é um fraco, uma molécula de Cl2 possui uma alta capacidade de entrar em conexão. O cloro reage com os metais, com a formação de sais, que são chamados de cloretos. Íons de cloro são os mais comuns de íons, estão contidos na água do mar. O cloro também tem dois isótopo: 35Cl e 37Cl. O cloreto de sódio é o mais comum é a junção de todos os cloretos.
Bromo – um elemento químico com número atômico 35 e o símbolo Br. Foi encontrado pela primeira vez em 1826 г. Na forma elementar bromo é um двухатомной molécula Br2. Quando a temperatura ambiente é um marrom-avermelhado, marrom líquido. COM – -1, + 1, 3, 4 e 5. Bromo mais ativo do que o iodo, mas é menos ativo do que o cloro. Além disso, o bromo tem dois isótopo: 79(Br e 81(Br. Bromo é encontrado na forma de sais de brometo, dissolvidos na água do mar. Nos últimos anos, a produção de brometo no mundo aumentou significativamente, graças à sua disponibilidade e longo tempo de vida. Como outros halogênios, bromoé oxidante e altamente tóxico.
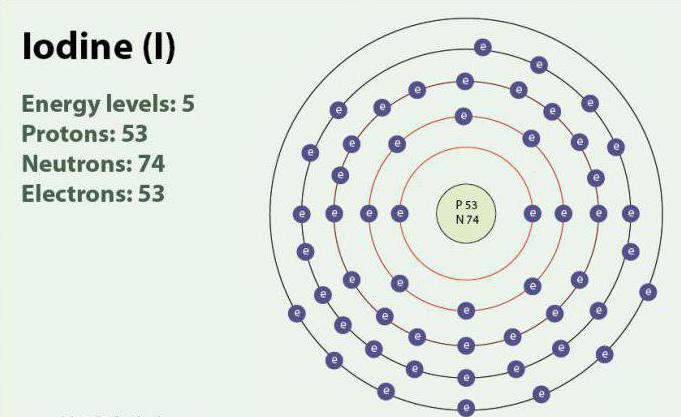
Iodo – um elemento químico com número atômico 53 e o símbolo I. o Iodo tem um grau de oxidação: -1, +1, +5 e +7. Existe na forma de двухатомной moléculas, I2. Quando a temperatura ambiente é sólido substância de cor violeta. O iodo tem um isótopo estável - 127I. descoberto pela Primeira vez em 1811 г. com a ajuda de algas e de ácido sulfúrico. Atualmente, os íons de iodo, podem ser destacadas na água do mar. Apesar do fato de que o iodo não é bem solúvel em água, sua solubilidade pode aumentar quando você usa individuais йодидов. Iodo desempenha um papel importante no organismo, participando na produção de hormônios da tireóide.
Астат – um elemento radioativo com o número atômico 85 e o símbolo do At. Possíveis grau de oxidação: -1, +1, 3, 5 e 7. A única halogênio, o que não é o двухатомной molécula. Em condições normais é de metal duro substância de cor preta. Астат é muito raro um elemento, por isso, pouco se sabe. Além disso, астат tem um período muito curto de meia-vida curta, não mais de algumas horas. Recebido em 1940 г. como síntese. Acredita-se que астат semelhante ao iodo. É diferente propriedades de metal.
A tabela A seguir mostra a estrutura de átomos de halogênio, a estrutura de camada externa de elétrons.
Halo | Configuração de elétrons |
O Flúor | 1s2 22 2p5 |
O | 3s2 3p5 |
Bromo | 3d10 4s2 4p5 |
O Iodo | 4d10 5s2 5p5 |
Астат | 4f14 5d10 6s2 6p5 |
Semelhante à estrutura externa da camada de elétrons determina que as propriedades físicas e químicas de halogênio semelhantes. No entanto, quando o mapeamento destes elementos observados e diferenças.
Propriedades Periódicas no grupo livre de halogênio
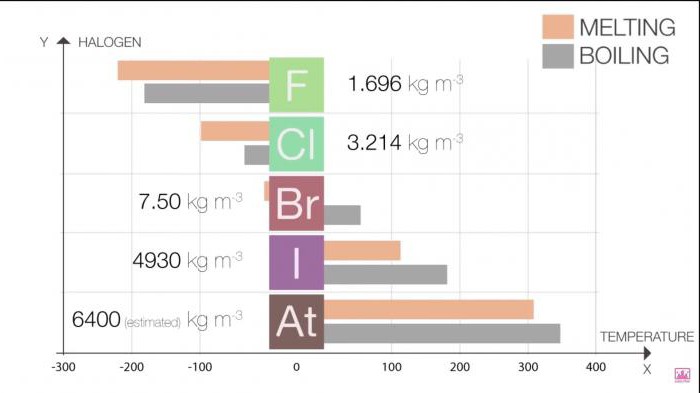
Propriedades Físicas de substâncias simples halogênios são alteradas com o aumento do número sequencial do item. Para uma melhor absorção e maior visibilidade nós oferecemos-lhe várias tabelas.
O Ponto de fusão e ponto de ebulição em grupo aumentam à medida que o crescimento do tamanho da molécula (F <um Cl <Br / <I <At). Este aumento significa um aumento de forças de Van der Waals.
A Tabela 1. Halogênios. Propriedades físicas: ponto de fusão e ponto de ebulição
Halo | T de fusão (C) | T de ebulição (C) |
O Flúor | -220 | -188 |
O | -101 | -35 |
Bromo | -7.2 | 58.8 |
O Iodo | 114 | 184 |
Астат | 302 | 337 |
- Raio Atômico aumenta.
Aumenta o Tamanho do kernel (F < um Cl < Br / < I < At), assim como aumenta o número de prótons e nêutrons. Além disso, cada período é adicionado mais níveis de energia. Isto leva a uma maior orbitals, e, portanto, a um aumento do raio de um átomo.
A Tabela 2. Halogênios. Propriedades físicas: raios atômicos
Halo | Ковалентный raio (pm) | Ion (X) raio (pm) |
O Flúor | 71 | 133 |
O | 99 | 181 |
Bromo | 114 | 196 |
O Iodo | 133 | 220 |
Астат | 150 |
- A Energia de ionização diminui.
Se os валентные os elétrons não estão perto de kernel para removê-los, ele não precisará de muita energia. Portanto, a energia necessária para expelir externo do elétron não é tão alta na parte inferior de um grupo de itens, assim como aqui mais os níveis de energia. Além disso, a alta energia de ionização faz com que o elemento de exercer a não-metálicos de qualidade. O iodo e a exposição de астат mostram metal propriedades, porque a energia de ionização diminui (At < I < Br / < um Cl < F).
A Tabela 3. Halogênios. Propriedades físicas: a energia de ionização
Halo | Energia de ionização (kj/mol) |
O flúor | 1681 |
O | 1251 |
Bromo | 1140 |
Iodo | 1008 |
астат | 890±40 |
- Electronegatividade dos reduzida.
O Número de elétrons de valência em um átomo aumenta com o aumento dos níveis de energia se progressivamente níveis mais baixos. Os elétrons progressivamente mais longe do núcleo; Portanto, o núcleo e os elétrons não são como se atraemuns aos outros. O aumento de blindagem pode ocorrer. Portanto, a electronegatividade dos diminui com o aumento do período (At < I < Br / < um Cl < F).
A Tabela 4. Halogênios. Propriedades físicas: electronegatividade dos
Halo | Electronegatividade dos |
O flúor | 4.0 |
O | 3.0 |
Bromo | 2.8 |
O iodo | 2.5 |
астат | 2.2 |
- Afinidade com a электрону diminui.
Assim como o tamanho do átomo aumenta com o aumento do período de afinidade com a электрону, geralmente, diminui (Em < I < Br / < F < Cl). Exceção – flúor, afinidade menos, do que o cloro. Isso pode explicar o menor tamanho de flúor em comparação com o cloro.
A Tabela 5. A afinidade de halogéneo, a электрону
Halo | Uma Afinidade com a электрону (kj/mol) |
O flúor | -328.0 |
O | -349.0 |
Bromo | -324.6 |
O iodo | -295.2 |
астат | -270.1 |
- Reatividade dos elementos é reduzida.
Reactividade livre de halogênio cai com o aumento do período (At <I <Br / <um Cl <F). Isto está relacionado com o aumento do raio de um átomo com o aumento dos níveis de energia de elétrons. Isso reduz a atração de elétrons de valência de outros átomos, reduzindo a reactividade. Esta redução também ocorre devido a uma queda электроотрицательности com o aumento do período, o que também reduz a atração de elétrons. Além disso, com o aumento do tamanho do átomo diminui e окислительная capacidade.
Inorgânicos. O hidrogênio + halogênios
Галогенид é formado quando um halogênio reage com outro, menos электроотрицательным elemento com a formação de binário composto. O hidrogênio reage com o галогенами, formando haletos tipo de НХ:
- фтороводород HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводород HI.
Os Halogenetos de hidrogênio dissolvem facilmente em água com a formação de галогенводородной (fluorídrico, sal, бромистоводородной, иодистоводородной de ácido. As propriedades destes ácidos abaixo.
O Ácido formado a seguinte reação: HX (aq) + H2O (l) → X (aq) + H3O+ (aq).
Todos os галоидоводороды formam ácidos fortes, exceto HF.
A Acidez галогеноводородных ácidos aumenta: HF <HCl <HBr <HI.
O ácido fluorídrico é capaz de gravar o vidro e alguns inorgânicos de flúor durante muito tempo.
Pode parecer contra-intuitivo, que HF é o mais fraco галогенводородной de ácido, assim como o flúor possui o maior электроотрицательностью. No entanto, a ligação H-F é muito forte, resultando em ácido muito fraco. A forte ligação determinado comprimento curto e uma grande energia de dissociação. De todos os halogenetos metálicos de hidrogênio HF tem mais curto o comprimento de comunicação e maior a energia de dissociação de ligação.
Halogênio оксокислоты
Halogênio оксокислоты representam um ácido com átomos de hidrogênio, de oxigênio e de halogéneo. Sua acidez pode ser determinada através de uma análise de estrutura. Halogênio оксокислоты a seguir:
- O hipocloroso HOCl.
- Хлористая ácido HClO2.
- Хлорноватая ácido HClO3.
- Хлорная ácido HClO4.
- Бромноватистая ácido HOBr.
- Бромноватая ácido HBrO3.
- Бромная ácido HBrO4.
- Иодноватистая ácido HOI.
- Йодноватая ácido HIO3.
- Метайодная ácido HIO4, H5IO6.
Em cada um desses ácidos próton ligado ao átomo de oxigênio, por isso, a comparação de comprimentos de ligações de prótons aqui é inútil. Um papel dominante aqui é o electronegatividade dos. A atividade de ácidos aumenta com o aumento do número de átomos de oxigênio, associado com o átomo central.
Aparência e o estado da matéria
Os Principais propriedades físicas livre de halogênio breve pode ser expresso na seguinte tabela.
O Estado da matéria (em temperatura ambiente) | Halo | Aparência |
Rígida | Iodo | Roxo |
астат | Preto | |
Líquido | Bromo | Vermelho-marrom |
Gasoso | O flúor | Pálido-amarelo-marrom |
O | Verde-claro |
Explicação a aparência
Cor de halogênio é o resultado da absorção de luz visível moléculas, o que provoca uma excitação de elétrons. O flúor absorve a luz violeta, e, portanto, parece-se amarelo claro. O iodo, pelo contrário, absorve a luz amarela e parece roxo (amarelo e roxo – complementam a cor). A cor de halogéneo, torna-se mais escura, com o crescimento do período.
No interior de reservatórios de líquido bromo e iodo sólido estão em equilíbrio com seus pares, o que pode ser observado na forma de cores de gás.
Embora a cor астата desconhecido, estima-se que ele deve ser mais escura de iodo (т. е. preto) de acordo com determinada regularidade.
Agora, se você for solicitado para: "Descreva as propriedades físicas de halogéneo," você será o que dizer.
O Grau de oxidação livre de halogênio de conexões
O Grau de oxidação é frequentemente usado em vez do conceito de "valência livres de halogênio. Geralmente, o grau de oxidação igual a -1. Mas se o halogênio está ligado com o oxigênio ou outros галогеном, ele pode receber de outro estado: COM oxigênio -2 tem prioridade. No caso de dois átomos de halogênio, dos estados, juntos, mais de электроотрицательный átomo prevalece e leva COM -1.
Por Exemplo, o cloreto de iodo (ICl) o cloro tem COM a -1, e o iodo +1. O cloro é mais электроотрицательным de iodo, portanto, COM a igual a -1.
Em бромной ácido (HBrO4) o oxigênio tem DE -8 (-2 x 4 do átomo = -8). O hidrogênio é um estado de oxidação +1. Somar esses valores dá COM -7. Assim como o destino DE ligação, tem de ser zero, ou COM o bromo é igual a +7.
A Terceira exceção à regra é o grau de oxidação de halogéneo na forma elementar (X2), onde DE é igual a zero.
Halo | COM conexões |
Flúor | -1 |
O | -1, +1, +3, +5, +7 |
Bromo | -1, +1, +3, +4, +5 |
Iodo | -1, +1, +5, +7 |
астат | -1, +1, +3, +5, +7 |
Por que o flúor é sempre -1?
Electronegatividade dos aumenta com o crescimento do período. Portanto, o flúor tem a mais alta electronegatividade dos de todos os elementos, o que confirma a sua posição na tabela periódica. A sua configuração electrónica 1s2 22 2p5. Se o flúor recebe mais um elétron, extremos de p-orbitals totalmente preenchido e compõem um total octeto. Porque o flúor tem uma elevada electronegatividade dos, ele pode facilmente selecionar o elétron tem uma vizinha de um átomo. O flúor neste caso, изоэлектронен инертному gás (com oito валентными elétrons), todas as suas externos orbitals preenchido. Em tal estado de flúor é muito mais estável.
A Obtenção e aplicação de halogênio
Na natureza halogênios estão em estado de ânions, portanto, livres de halogênios recebem o método de oxidação através da eletrólise ou com a ajuda de agentes oxidantes. Por exemplo, o cloro é produzido a hidrólise de solução de sal de cozinha. Aplicação livre de halogênio e de suas conexões diversificada.
- Flúor. Apesar do fato de que o flúor é muito реактивен, ele é usado em muitas áreas da indústria. Por exemplo, ele é a chave de componentes de politetrafluoretileno (teflon) e alguns outros de fluoropolímero. Хлорфторуглероды representam produtos químicos orgânicos, que eram utilizados como refrigerantes e пропеллентов nos aerossóis. A sua aplicação cessou devido a seu impacto sobre o meio ambiente. Eles foram substituídos por гидрохлорфторуглероды. O flúor é adicionado na sua pasta de dentes (SnF2) e água potável (NaF) para impedir a destruição dos dentes. Este halogênio está contido na argila utilizada para a produção de alguns tipos de cerâmica (LiF), é usado na indústria de energia nuclear (UF6), para obter um antibiótico фторхинолона de alumínio (Na3AlF6), para o isolamento de alta tensão de equipamentos (SF6).
- O também achei variadas aplicações. Ele é usado para a desinfecção de água potável e piscinas. Hipoclorito de sódio (NaClO) é o principal componente de arquibancadas. O ácido clorídrico é amplamente utilizado na indústria e em laboratórios. O cloro está presente em поливинилхлориде (PVC) e outros polímeros, que são utilizados para o isolamento da fiação, tubulações e eletrônica. Além disso, o cloro foi útil e na indústria farmacêutica. Medicamentos contendo cloro, utilizado para o tratamento de infecções, alergias e diabetes. Neutro forma de cloridrato – um componente de muitos medicamentos. O cloro também é utilizado para a esterilização hospitalar equipamentos e desinfecção. Na agricultura, o cloro é um componente de muitos comerciais de pesticidas: DDT (дихлородифенилтрихлорэтан) foi usado como inseticida agrícola, mas o seu uso foi descontinuado.

- Bromo, graças a sua негорючести, aplica-se para a supressão de combustão. Ele também é encontrado no бромистом метиле, no insecticida, usado para o armazenamento da colheita e a supressão de bactérias. No entanto, o uso excessivo de brometo foi interrompido por causa de seu efeito sobre a camada de ozônio. Bromo, aplicar-se para a produção de gasolina, filme fotográfico, extintores de incêndio, de medicamentos para o tratamento de pneumonia e doença de Alzheimer.
- Iodo desempenha um papel importante no bom funcionamento da tireóide. Se o corpo não recebe a quantidade suficiente de iodo, ocorre um aumento da glândula tireóide. Para a prevenção do bócio o halogênio adicionado em поваренную sal. O iodo também é usado como антисептического ferramentas. O iodo contido em soluções utilizadas paraa limpeza de feridas abertas, bem como na desinfecção спреях. Além disso, o iodeto de prata é essencial na fotografia.
- Астат – radioisótopos e редкоземельный de halogênio, portanto, ainda não é usado em nenhum outro lugar. No entanto, acredita-se que este item pode ajudar iodo na regulação de hormônios da tireóide.
Article in other languages:

Alin Trodden - autor do artigo, editor
"Olá, sou o Alin Trodden. Escrevo textos, leio livros e procuro impressões. E eu não sou ruim em falar sobre isso. Estou sempre feliz em participar de projetos interessantes."
Notícias Relacionadas
o Sistema, integrando todos os órgãos, também chamados de funcionais de sistemas. Tais estruturas em vegetais e animais organismos existem para cumprir o seu papel.o Que é o sistema de órgãoso Sistema, integrando todos os órgãos, ...
O princípio de consciência e a atividade dos alunos para uma aprendizagem bem sucedida
ao longo de centenas de anos de seu desenvolvimento, pedagogia destacou uma série de princípios que afetam o sucesso da aprendizagem, a assimilação de conhecimentos pelos alunos. Todos eles estão interligados entre si, e usá-los e...
Uma breve paráfrase. "Caucasiano cativo" de Sasha Preto
Para economizar o tempo de cada um de nós, pelo menos uma vez na vida leu uma breve paráfrase. ão Caucasiano cativoç ã o de história, escrito por Sasha Preto no início do século XX. Esta é uma pequena obra de ...
Ferro: a estrutura de um átomo, o esquema e exemplos. Eletrônico a estrutura de um átomo de ferro
Considere eletrônico para a construção de um átomo de ferro, bem como a sua localização na tabela Periódica. Identificar as principais propriedades físicas e químicas deste elemento, área de uso.a Posição que o PSo Ferro é um d-el...
Profissional de reciclagem de professores
o Rápido período de tempo todos os dias demonstra a necessidade de desenvolvimento e melhoria contínua em vários campos de actividade. Algumas profissões tornam-se menos relevante, outros são mais procurados, aparecem novos, com g...
Deprimido é... a Definição deste conceito e métodos de resolução de conflito interno
o Que é "deprimido"? O significado dessa palavra, vamos tentar desvendar este artigo. Se a falar sobre o estado de espírito, então cada pessoa, pelo menos uma vez na vida sentia essa sensação de desconforto. Por quais razões isso ...





















Comentários (0)
Este artigo possui nenhum comentário, seja o primeiro!