الهالوجينات: الخصائص الفيزيائية والكيميائية. استخدام الهالوجينات ومركباتها
الهالوجينات في الجدول الدوري يقع إلى اليسار من الغازات النبيلة. هذه خمسة سامة ، غير الفلزية العناصر في مجموعة 7 من الجدول الدوري. وتشمل هذه الفلور والكلور والبروم واليود astatine. على الرغم من أن astatine هو المشعة فقط قصيرة الأجل النظائر ، فإنه يتصرف مثل اليود و هو غالبا ما يشار إلى الهالوجينات. لأن الهالوجين العناصر سبعة إلكترونات التكافؤ ، فإنها تحتاج إضافية واحدة فقط الإلكترون إلى شكل كامل الثماني. هذه الميزة يجعلها أكثر نشاطا من الفئات الأخرى من غير المعادن.
الخصائص العامة
الهالوجينات شكل جزيئات ثنائية الذرة (شكل X2, حيث X هو الهالوجين) – المستدامة شكل وجود الهالوجينات في شكل عناصر مجانية. العلاقة بين هذه جزيئات ثنائية الذرة غير القطبية ، التساهمية واحد. الخصائص الكيميائية الهالوجينات يسمح لهم الدخول بسهولة إلى السندات مع معظم العناصر, حتى أنها لم يجتمع في غير منضم شكل في الطبيعة. الفلورايد – الأكثر نشاطا الهالوجين astatine – على الأقل.
جميع الهالوجينات شكل أملاح المجموعة الأولى مع خصائص مماثلة. في هذه المركبات ، الهالوجينات موجودة هاليد الأنيونات مع تهمة -1 (مثل Cl- Br-). نهاية معرف يشير إلى وجود هاليد الأنيونات; على سبيل المثال ، Cl- يسمى "كلوريد".
وبالإضافة إلى ذلك ، فإن الخصائص الكيميائية الهالوجينات يسمح لهم بمثابة العوامل المؤكسدة – إلى أكسدة المعادن. معظم التفاعلات الكيميائية التي تنطوي على الهالوجينات – الأكسدة والاختزال في محلول مائي. الهالوجينات شكل واحد سندات الكربون أو النيتروجين في المركبات العضوية ، حيث درجة الأكسدة (CO) -1. عندما ذرة الهالوجين استبداله تساهميا-لا بد ذرة الهيدروجين في مركب عضوي ، البادئة هالة - يمكن استخدامها في الشعور العام ، أو البادئات الفلوري-الكلور-البروم - اليود – المحددة الهالوجينات. الهالوجين العناصر يمكن أن يكون عبر اتصال مع تشكيل جزيئات ثنائية الذرة مع التساهمية القطبية السندات واحدة.
المزيد
أساليب التدريس التفاعلية في جامعة
أساليب التدريس التفاعلية هي واحدة من أهم وسائل تحسين التدريب المهني من الطلاب في التعليم العالي. المعلم هو الآن لا يكفي أن تكون ببساطة المختصة في الانضباط ، وإعطاء المعرفة النظرية في الفصول الدراسية. تحتاج بعض نهج مختلف الحديثة في العملية التعليمية.ن...
البرازيل الذي أعداد السكان في المرتبة الخامسة المرتبة الثانية بعد الهند والصين وإندونيسيا وأمريكا – متنوعة جدا البلد. لعدة مئات من السنين الأمة أصبح من أهم العرقية-الثقافية والتعليم. سكان البرازيل هو أكثر من مائة القوميات والشعوب. في هذا ...
مستعمرة من بريطانيا – العديد من المناطق في جميع أنحاء العالم ، الذين تم القبض عليهم ، تؤخذ تحت الحماية أو بعض الوسائل المكتسبة بين 16 و 18 قرون واحدة من أقوى الإمبراطوريات في الماضي – البريطانية. وكان الهدف من التنمية الإقليمية. خلال الفت...
الكلور (Cl2) كان أول من الهالوجين التي سيتم افتتاحها في عام 1774 ، ثم تم اكتشاف اليود (I2) ، البروم (Br2) ، الفلور (F2) ، astatine (في اكتشاف آخر في عام 1940). اسم “هالة" يأتي من جذور يونانية هال - (&[لدقوو] ؛ الملح”) و جنرال (&[لدقوو] ؛ &ردقوو];). هذه الكلمات تعني “salt” ، وتسليط الضوء على حقيقة أن الهالوجين يتفاعل مع المعادن على شكل أملاح. غاليت – اسم من الملح الصخري الطبيعي المعدنية تتكون من كلوريد الصوديوم (كلوريد الصوديوم). وأخيرا ، الهالوجينات تستخدم في الحياة اليومية &ndash ؛ الفلورايد الموجودة في معجون الأسنان ، الكلور يطهر مياه الشرب و اليود يعزز هرمونات الغدة الدرقية.
العناصر الكيميائية
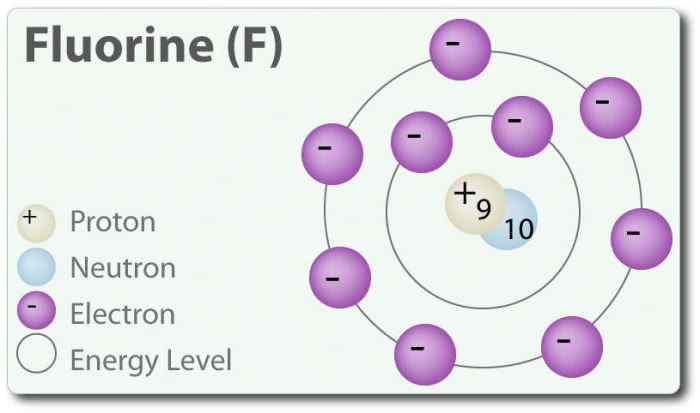
الفلورايد – العنصر العدد الذري 9 ممثلة بالرمز F. عنصر الفلور اكتشفت لأول مرة في عام 1886 من قبل عزلها من حمض الهيدروفلوريك. في دولة حرة الفلور يوجد في جزيء ثنائي الذرة (F2) و هو الأكثر وفرة الهالوجين في قشرة الأرض. الفلور أكثر كهربية العنصر في الجدول الدوري. في درجة حرارة الغرفة هو أصفر شاحب الغاز. الفلور أيضا صغير نسبيا القطر الذري. مع ذلك – -1 ، باستثناء عنصري ثنائي الذرة الدولة التي لها حالة الأكسدة هي صفر. الفلور هو رد الفعل جدا ويتفاعل مباشرة مع جميع العناصر ما عدا الهيليوم (He), النيون (Ne) و الأرجون (Ar). في حل من H2O, حمض الهيدروفلوريك (HF) هو حمض ضعيف. على الرغم من الفلور للغاية كهربية ، الكهربية لا تحدد الحموضة; HF هو حمض ضعيف يرجع ذلك إلى حقيقة أن أيون الفلوريد الأساسية (pH> 7). وبالإضافة إلى ذلك, الفلور تنتج جدا قوي للتأكسد. على سبيل المثال, الفلور يمكن أن تتفاعل مع غاز خامل زينون و أشكال عامل مؤكسد قوي زينون difluoride (XeF2). و الفلور في العديد من الاستخدامات.
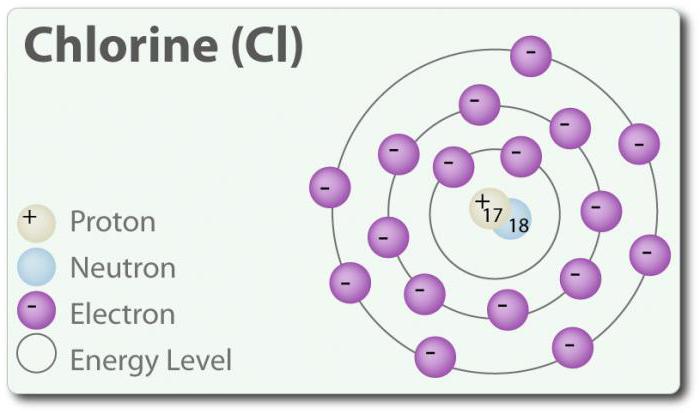
الكلور – العنصر العدد الذري 17 و الكيميائية رمز Cl. اكتشف في عام 1774 من فصل من حمض الهيدروكلوريك. في عنصري الدولة ، فإنه يشكل جزيء ثنائي الذرة Cl2. الكلور عدة من: -1, +1, 3, 5 و 7. في درجة حرارة الغرفة وهو أخضر شاحب الغاز. لأن السندات التي يتم تشكيلها بين اثنين من ذرات الكلور ضعيف ، جزيء Cl2 لديه قدرة عالية جدا على الدخول في اتصال. الكلور يتفاعل مع المعادن على شكل تسمى أملاح الكلوريدات. أيونات الكلوريد هي الأكثر شيوعا الأيونات الموجودة في مياه البحر. الكلور اثنين من النظائر: 35Cl 37Cl. كلوريد الصوديوم هو الاتصال الأكثر شيوعا من جميع الكلوريدات.
بروميتش البيون &ndash ؛ عنصر كيميائي له العدد الذري 35 و رمز Br. كان أول من اكتشف في عام 1826 في عنصري شكل البروم ثنائي الذرة الجزيء Br2. في درجة حرارة الغرفة هو البني المحمر السائل. مع ذلك – -1, + 1, 3, 4 و 5. البروم هو أكثر نشاطا من اليود ، ولكن أقل نشاطا من الكلور. وبالإضافة إلى ذلك, البروم اثنين من النظائر: 79Br و 81VG. البروم هو العثور على بروميد الأملاح الذائبة في مياه البحر. في السنوات الأخيرة, إنتاج بروميد الميثيل في العالم ازداد بشكل ملحوظ بسبب سهولة و حياة طويلة. مثل الهالوجينات الأخرى ، البرومهو مؤكسد و شديدة السمية.
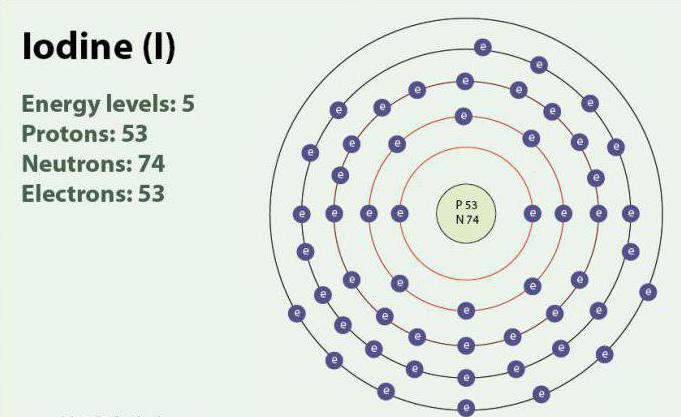
اليود عنصر كيميائي مع العدد الذري 53 و رمز I. اليود قد الأكسدة الدول: -1, +1, +5 و +7. يوجد في جزيء ثنائي الذرة ، أنا2. في درجة حرارة الغرفة هو اللون الأرجواني الصلبة. اليود واحد النظائر المستقرة 127I. اكتشفت لأول مرة في عام 1811 مع مساعدة من الأعشاب البحرية ، حمض الكبريتيك. في الوقت الحاضر, أيونات اليود يمكن أن تكون معزولة في مياه البحر. على الرغم من حقيقة أن اليود هو قابل للذوبان في الماء ، ذوبانه قد تزيد إذا كنت تستخدم بعض اليود. اليود يلعب دورا هاما في الجسم ، ويساعد في إنتاج هرمونات الغدة الدرقية.
ASTAT – العنصر المشع مع العدد الذري من 85 الرمز. ممكن الأكسدة الدول: -1, +1, 3, 5 و 7. فقط الهالوجين ليست جزيء ثنائي الذرة. في ظل ظروف طبيعية معدنية صلبة سوداء. Astatine هو العنصر النادر جدا, لذلك هو غير معروفة. وبالإضافة إلى ذلك ، astatine وقد قصيرة جدا نصف العمر لا تتجاوز بضع ساعات. تلقى في عام 1940 نتيجة التوليف. وأعتقد أن astatine مشابه اليود. مختلف المعادن خصائص.
الجدول أدناه يوضح هيكل من ذرات الهالوجين ، بنية الطبقة الخارجية من الإلكترونات.
هالو | الإلكترون التكوين |
الفلور | 1s2 22 2p5 |
الكلور | 32 3p5 |
بروميتش البيون | 3d10 4s2 4p5 |
اليود | 410 52 55 |
Astatine | 4f14 510 6s2 65 |
هذا الهيكل الخارجي طبقة من الإلكترونات يحدد الخواص الفيزيائية والكيميائية من الهالوجينات متشابهة. ومع ذلك ، عند مقارنة هذه البنود ، لوحظت فروق معنوية.
الدوري الخصائص في مجموعة الهالوجينات
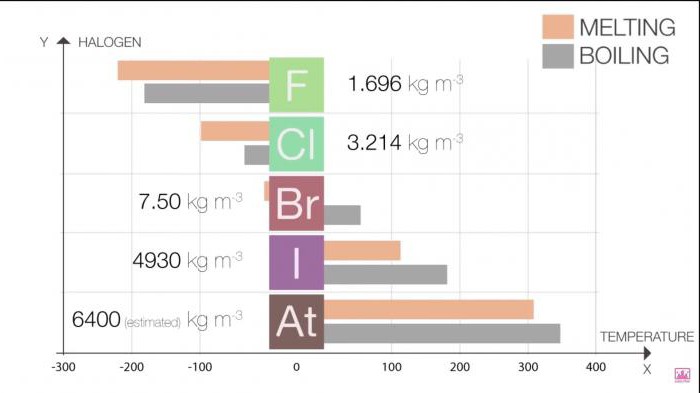
الخصائص الفيزيائية البسيطة مركبات الهالوجينات تتغير مع زيادة عدد ترتيبي عنصر. أفضل امتصاص أكبر قدر من الوضوح ، ونحن نقدم لكم عدد قليل من الجداول.
نقطة انصهار و غليان في المجموعة زيادة النمو في حجم جزيء (F <Cl <Br <أنا <في). هذه الزيادة تعني زيادة في قوة فان دير فال.
الجدول 1. الهالوجينات. الخصائص الفيزيائية: نقطة انصهار و غليان
<الجدول محاذاة="مركز" cellpadding="5" cellspacing="0" على غرار="العرض: 472px;">هالو
T الذوبان (ج)
T نقطة الغليان (ج)
الفلور
-220
-188
الكلور
-101
-35
بروميتش البيون
-7.2
58.8
اليود
114
184
Astatine
302
337
- القطر الذري يزيد.
جوهر حجم الزيادات (F < Cl < Br < أنا < في) ، كما أنه يزيد من عدد من البروتونات والنيوترونات. بالإضافة إلى ذلك, كل فترة يضيف المزيد من مستويات الطاقة. وهذا يؤدي إلى زيادة المدارية ، وبالتالي إلى زيادة نصف قطر الذرة.
الجدول 2. الهالوجينات. الخصائص الفيزيائية: الذرية الاقطار
<الجدول محاذاة="مركز" cellpadding="5" cellspacing="0" style="width: 75%;">الهالوجين
التساهمية دائرة نصف قطرها (م)
أيون (X-) دائرة نصف قطرها (م)
الفلور
71
133
الكلور
99
181
بروميتش البيون
114
196
اليود
133
220
Astatine
150
- التأين انخفاض الطاقة.
إذا كان الخارجي إلكترونات التكافؤ تكن بالقرب من النواة ، ثم إزالة ذلك لن تحتاج إلى الكثير من الطاقة. وبالتالي فإن الطاقة اللازمة لإخراج الخارجي الإلكترونات ليست عالية جدا في الجزء السفلي من مجموعة عناصر ، كما أن هناك أكثر من مستويات الطاقة. وبالإضافة إلى ذلك ، فإن عالية التأين يجعل العنصر أن تكون غير نوعية. اليود و astatine عرض الخصائص المعدنية المعرض ، لأن التأين النقصان (At < أنا < Br < Cl < F).
الجدول 3. الهالوجينات. الخصائص الفيزيائية: التأين
<الجدول محاذاة="مركز" cellpadding="5" cellspacing="0" style="width: 50%;">هالو
التأين الطاقة (كيلو جول/مول)
الفلور
1681
الكلور
1251
بروميتش البيون
1140
اليود
1008
Astatine
890 ± 40
- الكهربية النقصان.
عدد إلكترونات التكافؤ فى ذرة يزيد مع زيادة في مستويات الطاقة تدريجيا في مستويات أقل. التدريجي الإلكترونات بعيدا عن النواة ، فإن النواة و الإلكترونات ليست كما جذبتإلى بعضها البعض. زيادة التدريع لوحظ. ولذلك الكهربية تتناقص مع زيادة الفترة (At < أنا < Br < Cl < F).
الجدول 4. الهالوجينات. الخصائص الفيزيائية: الكهربية
<الجدول محاذاة="مركز" cellpadding="5" cellspacing="0" style="width: 50%;">هالو
الكهربية
الفلور
4.0
الكلور
3.0
بروميتش البيون
2.8
اليود
2.5
Astatine
2.2
- الإلكترون تقارب النقصان.
حجم الذرة يزيد مع زيادة الفترة الإلكترون تقارب عموما يقلل من (< أنا < Br < و < Cl). الاستثناء – الفلور ، المتقاربة التي هي أقل من الكلور. ويمكن تفسير ذلك من خلال حجم أصغر من الفلور مقارنة مع الكلور.
الجدول 5. تقارب من الهالوجينات إلى الإلكترون
<الجدول محاذاة="مركز" cellpadding="5" cellspacing="0" style="width: 50%;">هالو
الإلكترون تقارب (كيلوجول/مول)
الفلور
-328.0
الكلور
-349.0
بروميتش البيون
-324.6
اليود
-295.2
Astatine
-270.1
- تفاعل العناصر النقصان.
تفاعل الهالوجينات تتناقص مع زيادة الفترة (At <أنا <Br <Cl <F). ويرجع ذلك إلى زيادة نصف قطر الذرة مع زيادة مستويات الطاقة من الإلكترونات. وهذا يقلل من جذب إلكترونات التكافؤ إلى ذرات أخرى ، وخفض التفاعل. هذا التخفيض يحدث أيضا بسبب سقوط الكهربية مع زيادة الفترة ، مما يقلل أيضا من جذب الإلكترونات. وبالإضافة إلى ذلك ، مع زيادة حجم الذرة يقلل قدرة التأكسدي.
الكيمياء غير العضوية. الهيدروجين + الهالوجينات
على هاليد عندما تشكلت الهالوجين يتفاعل مع آخر أقل كهربية عنصر مع تشكيل مركبات ثنائي. الهيدروجين يتفاعل مع الهالوجينات لتكوين هاليدات من شكل HX:
- فلوريد الهيدروجين HF;
- كلوريد الهيدروجين HCl;
- Bromovalerate HBr ؛
- Yodovidona مرحبا.
على هاليدات الهيدروجين تذوب بسهولة في الماء على شكل halogenoalkanes (الهيدروفلوريك ، الهيدروكلوريك bromatological, itestosterone حمض). خصائص هذه الأحماض أدناه.
حمض شكلت رد فعل التالية: HX (aq) + H2O (l) → X- (aq) + H3O+ (aq).
كل halomonadaceae شكل الأحماض القوية إلا HF.
حموضة hydrohalic الأحماض يزيد: HF <HCl <HBr <مرحبا.
حمض الهيدروفلوريك يمكن حفر الزجاج وبعض الفلوريد غير العضوية لفترة طويلة.
قد يبدو أمرا غير متوقع أن HF هو أضعف halogenation حمض لأن الفلور أعلى الكهربية. ومع ذلك ، فإن السندات ن-و هو قوي جدا ، مما تسبب حمض ضعيف جدا. رابطة قوية يتحدد طول قصيرة من الارتباط كبير التفكك الطاقة. كل هاليدات الهيدروجين HF لديها أقصر طول الاتصالات و الطاقة أكبر من السندات التفكك.
الهالوجين oxoacid
الهالوجين oxoacid تمثل حمض مع ذرات من الهيدروجين والأكسجين الهالوجينات. الحموضة يمكن تحديده من خلال تحليل هيكل. الهالوجين oxoacid هو مبين أدناه:
- حمض تحت الكلور هو حوكل.
- حمض الهيدروكلوريك HClO2.
- كلوري حمض HClO3.
- حمض البيركلوريك HClO4.
- Bromoviridae حمض HOBr.
- Vranovaca حمض HBrO3.
- البروم حمض HBrO4.
- Innovatica حمض هوي.
- ألفا iodic حمض HIO3.
- Medioda حمض HIO4, H5IO6.
في كل من هذه الأحماض ، البروتون ترتبط ذرة الأكسجين ، وبالتالي فإن المقارنة بين السندات أطوال البروتونات هي عديمة الفائدة. المهيمن هو الدور الذي تلعبه الكهربية. نشاط حمض يزيد مع زيادة عدد ذرات الأكسجين المرتبطة وسط الذرة.
والمظهر دولة الموضوع
أهم الخصائص الفيزيائية الهالوجينات يمكن بإيجاز عن في الجدول التالي.
الدولة من المسألة (في درجة حرارة الغرفة) | هالو | المظهر |
الصلبة | اليود | الأرجواني |
Astatine | السوداء | |
السائل | بروميتش البيون | الأحمر والبني |
الغازي | الفلور | أصفر شاحب اللون البني |
الكلور | أخضر شاحب |
شرح المظهر
لون الهالوجينات هو نتيجة امتصاص الضوء المرئي من الجزيئات التي تسبب الإثارة من الإلكترونات. الفلور يمتص الضوء البنفسجي ، وبالتالي تبدو الضوء الأصفر. اليود ، على العكس من ذلك, تمتص الضوء الأصفر و يبدو البنفسجي (الأرجواني والأصفر – اللون المكمل). لون الهالوجينات تصبح أكثر قتامة مع زيادة الفترة.
في حاويات مغلقة من البروم السائل الصلبة اليود هي في حالة توازن مع الأبخرة التي يمكن ملاحظتها في شكل الملونة الغاز.
على الرغم من أن لون astatine غير معروف ، فمن المفترض أنه يحتاج إلى أن يكون أكثر قتامة اليود (أي أسود) وفقا لوحظ نمط.
إن سأل: “وصف الخصائص الفيزيائية الهالوجينات” ، سيكون لديك ما تقوله.
حالة الأكسدة من الهالوجينات في مركبات
درجة الأكسدة غالبا ما تستخدم بدلا من مفهوم "التكافؤ من الهالوجينات". وكقاعدة عامة ، فإن حالة الأكسدة -1. ولكن إذا الهالوجين يرتبط مع الأكسجين أو مع آخر الهالوجين ، قد يستغرق شرط آخر: الأكسجين قد -2 الأولوية. في حالة اثنين من مختلف ذرات الهالوجين المستعبدين معا أكثر كهربية ذرة يسود يأخذ مع -1.
على سبيل المثال كلوريد اليود (ICl) الكلور لديه -1 و اليود +1. الكلور هو أكثر كهربية من اليود لذا -1.
في حمض البروم (HBrO4), الأوكسجين مع -8 (-2 × 4 ذرات = -8). الهيدروجين يبلغ حالة الأكسدة +1. إضافة هذه القيم يعطي مع -7. كما هو الحال مع الاتصالات النهاية يجب أن يكون صفرا ، ثم البروم هو +7.
الثالث استثناء من القاعدة هو حالة الأكسدة الهالوجين في عنصري شكل (X2) ، حيث أنه من الصفر.
هالو | اتصال |
الفلور | -1 |
الكلور | -1, +1, +3, +5, +7 |
بروميتش البيون | -1, +1, +3, +4, +5 |
اليود | -1, +1, +5, +7 |
Astatine | -1, +1, +3, +5, +7 |
لماذا الفلور هو دائما -1?
الكهربية يزيد مع زيادة الفترة. ولذلك الفلور أعلى الكهربية من جميع العناصر ، كما يتضح من موقعها في الجدول الدوري. الإلكترونية التكوين 1s2 22 2p5. إذا الفلورايد يحصل أكثر واحد إلكترون الأبعد p-المدارات هي مليئة تماما و هي كاملة الثماني. منذ الفلور العالية الكهربية ، فإنه يمكن بسهولة أن الإلكترون من مجاورة ذرة. الفلور في هذه الحالة isoelectronic غاز خامل (ثمانية إلكترونات التكافؤ), جميع المدارات الخارجية تمتلئ. في هذه الحالة, الفلور هو أكثر استقرارا.
إنتاج واستخدام الهالوجينات
في الطبيعة ، الهالوجين في حالة من الأنيونات ، لذلك خالية الهالوجين التي تنتجها الأكسدة عن طريق التحليل الكهربائي أو باستخدام عوامل مؤكسدة. على سبيل المثال, الكلور المنتجة عن طريق التحلل من محلول الملح. استخدام الهالوجينات ومركباتها متنوعة.
- الفلورايد. على الرغم من حقيقة أن الفلور هو رد الفعل جدا ، فإنه يستخدم في العديد من الصناعات. على سبيل المثال, بل هو عنصر أساسي من polytetrafluoroethylene (تفلون) وغيرها fluoropolymers. مركبات الكربون الكلورية فلورية هي المواد الكيميائية العضوية التي كانت سابقا تستخدم في المبردات الدواسر في الهباء. استخدام توقفت بسبب تأثير ممكن على البيئة. تم الاستعاضة عن مركبات الكربون الهيدروكلورية فلورية. الفلورايد هو تضاف إلى معجون الأسنان (SnF2) ومياه الشرب (NaF) لمنع تسوس الأسنان. هذا الهالوجين هو الوارد في الطين المستخدمة لإنتاج أنواع معينة من السيراميك (LiF) يستخدم في مجال الطاقة النووية (UF6) للحصول على المضادات الحيوية الفلوري ، الألومنيوم (Na3آلف6) ، عزل عالية الجهد المعدات (SF6).
- الكلور كما وجدت تطبيقات متنوعة. فهو يستخدم لتطهير مياه الشرب وحمامات السباحة. هيبوكلوريت الصوديوم (NaClO) هو العنصر الرئيسي من التبييض. حمض الهيدروكلوريك على نطاق واسع في الصناعة والمختبرات. الكلور موجود في البولي فينيل كلوريد (PVC) وغيرها من البوليمرات التي تستخدم في عزل الأسلاك والأنابيب الالكترونيات. وبالإضافة إلى ذلك, الكلور أثبتت أنها مفيدة في صناعة المستحضرات الصيدلانية. المنتجات الطبية التي تحتوي على الكلور, تستخدم لعلاج التهابات الحساسية و مرض السكري. محايد شكل هيدروكلوريد-مكون من العديد من الأدوية. الكلور هو أيضا يستخدم في التعقيم في المستشفيات معدات التطهير. في الزراعة الكلور مكون من العديد من المبيدات التجارية: دي. دي. تي (مادة ال) كان يستخدم كمبيد حشري زراعي ، ولكن استخدامه كان وقفها.

- البروم ، بسبب اللااحتراقية ، يتم استخدامه لقمع الاحتراق. كما أنها وجدت في بروميد الميثيل ، المبيدات المستخدمة لتخزين المحاصيل ومكافحة البكتيريا. ولكن الإفراط في استخدام بروميد الميثيل توقفت بسبب تأثيرها على طبقة الأوزون. على البروم وتستخدم في إنتاج البنزين, فيلم, طفايات الحريق ، أدوية علاج الالتهاب الرئوي ومرض الزهايمر.
- اليود يلعب دورا هاما في حسن سير العمل في الغدة الدرقية. إذا كان الجسم لا يحصل على ما يكفي من اليود في الغدة الدرقية. الوقاية من تضخم الغدة الدرقية ، الهالوجين يضاف إلى ملح الطعام. اليود كما يستخدم مطهر. اليود الواردة في الحلول المستخدمةتنظيف الجروح المفتوحة و أيضا في بخاخ مطهر. بالإضافة إلى ذلك ، يوديد الفضة المهم في التصوير الفوتوغرافي.
- Astatine – المشعة النادرة الهالوجين ، لذلك لم تستخدم. ومع ذلك ، يعتقد أن هذا العنصر يمكن أن يساعد اليود في تنظيم هرمونات الغدة الدرقية.
Article in other languages:

Alin Trodden - مؤلف المقال ، محرر
"مرحبا ، أنا ألين الدوس. أنا أكتب النصوص ، وقراءة الكتب ، والبحث عن الانطباعات. وأنا لست سيئة في أقول لك عن ذلك. أنا دائما سعيد للمشاركة في مشاريع مثيرة للاهتمام."
أخبار ذات صلة
القدس: تاريخ تأسيس المدينة المقدسة
كل تاريخ البشرية كانت هناك العديد من المدن الشهيرة. ولكن الأكثر غموضا منهم القدس. تاريخ هذا المكان يعرف أكثر من الحرب من أي مكان على هذا الكوكب. على الرغم من هذا, المدينة نجا اليوم لا تزال تزدهر باعتبارها الأماكن المقدسة للأديان ا...
الظاهر هو الخارجي الطبقة الجرثومية
الظاهر هو جزء من أي الحيوانات متعددة الخلايا. فقط بعض من هذا الهيكل لا يزال فقط في فترة التطور الجنيني ، في حين أن آخرين - في العمر. ما هو الظاهر?أنواع من جرثومة طبقةخلال مراحل نمو البويضة المخصبة تنقسم عدة مرات ، مع مرور الوقت تش...
عهد اليكسي ميخائيلوفيتش هدوءا. ترتيب الشؤون السرية
إنشاء ترتيب الشؤون السرية (السنة من تشكيل ما يقرب من 1653-y) ، التي بدأها اليكسي ميخائيلوفيتش هدوءا ، قد هدفين. فمن ناحية ، كان يستخدم مكتب خاص الإمبراطور. من ناحية أخرى - ترتيب الشؤون السرية بمثابة السلطة العامة ، مع حالة من الشع...
الذين سوف تكون عندما تكبر ؟ مشكلة الاختيار الوظيفي: حجج من الأدب
“عندما يكبر ، أنا متأكد&hellip ؛ &ردقوو] ؛ العبارة كثيرا ما نسمع من الأطفال الذين يريدون أن تكون الرياضيين والمعلمين والأطباء أو الطهاة. هذا فقط كبار السن يصبح الطفل, كلما كان من الصعب بشكل لا لبس فيه الإجابة على هذا السؤال....
القائد – رتبة في الجيش القوزاق. الأول كان يسمى مساعد قائد في وقت لاحق كابتن يمكن مساواته مع القائد أو القائد. ماذا تعني هذه الكلمة ؟ انجليزيهووفقا لنسخة واحدة ، Esaul – وهي كلمة من أصل تركي. في بعض أخبار ابن جنكيز خان ...
تانيا Savicheva: السيرة الذاتية, يوميات الحصار و حقائق مثيرة للاهتمام
المعتادة لينينغراد الفتاة تانيا Savicheva أصبح العالم الشهير بفضل المذكرات التي قادت إلى 1941 – 1942 أثناء حصار لينينغراد. وقد أصبح هذا الكتاب واحد من أهم رموز تلك الأحداث الرهيبة.مكان وتاريخ الميلادتانيا Savicheva ولد في 23...






















تعليقات (0)
هذه المادة قد لا تعليق أول