Now - 18:19:35
Атом у хімії - це... Модель атома. Будова атома
Думки про сутність всього навколишнього почали відвідувати людство задовго до розквіту сучасної цивілізації. Спочатку люди міркували про існування якихось вищих сил, які, як вони вважали, зумовлювали все буття. Але вже досить скоро філософи і священнослужителі почали замислюватися над тим, з чого, власне, складається сама тканина цього буття. Теорій було безліч, але в історичній перспективі головною стала атомарна.
 Що таке атом у хімії? Це, а також всі супутні теми ми обговоримо в рамках даної статті. Сподіваємося, що в ній ви знайдете відповіді на всі ваші питання.
Що таке атом у хімії? Це, а також всі супутні теми ми обговоримо в рамках даної статті. Сподіваємося, що в ній ви знайдете відповіді на всі ваші питання.
Родоначальник атомарної теорії
З чого починається перший урок хімії? Будова атома – ось головна тема. Ви напевно пам'ятаєте, що слово «атом» перекладається з давньогрецької мови як «неподільний». Зараз багато істориків вважають, що першим висунув теорію, в якій йшлося про якихось найдрібніших частинках, з яких складається все суще, Демокріт. Він жив ще в п'ятому столітті до нашої ери.
На превеликий жаль, про цього видатного мислителя практично нічого не відомо. До нас не дійшов жоден письмовий джерело тих часів. А тому про ідеї видатного вченого свого часу нам доводиться дізнаватися виключно з праць Аристотеля, Платона, а також інших давньогрецьких мислителів.
Отже, наша тема - "Будова атома". З хімії не всі мали високі оцінки, але багато хто пам'ятає про те, що всі висновки стародавніх вчених були побудовані виключно на умовиводах. Демокріт винятком не був.
Як міркував Демокріт?
Логіка його була гранично проста, але разом з тим геніальна. Уявіть, що у вас є самий гострий ніж у всьому світі. Ви берете яблуко, наприклад, а потім починаєте його розрізати: на дві половинки, четвертинки, їх знову ділите... Словом, рано чи пізно ви отримаєте скибки такою мізерною товщини, що далі їх ділити вже буде не можна. Ось це і буде неподільний атом. У хімії це твердження вважалося істинним чи не до кінця 19 століття.
Від Демокріта до сучасними уявленнями
Слід зауважити, що від давньогрецьких уявлень про мікросвіті збереглося одне тільки слово «атом». Зараз кожен школяр знає, що навколишній світ складається з куди більш фундаментальних і дрібних частинок. Крім того, з точки зору сучасної науки теорія Демокріта була не більш ніж чисто гіпотетичною викладкою, не підкріпленої рівним рахунком ніякими доказами. Втім, у ті часи не було електронних мікроскопів, так що довести свою правоту іншими способами у мислителя б все одно не вийшло.
Більше:
Перший штучний супутник Землі є одним з найбільших досягнень науки ХХ століття. Тим не менш, як це ні парадоксально, цьому великому науковому і технічному досягненню значною мірою сприяла холодна війна між двома наддержавами: США і Радянським Союзом....
Що таке соціалізація, і як вона змінює людину
Спробуємо розібратися, що таке соціалізація, в чому її сутність і особливість. Адже для кожної особистості входження у суспільство і засвоєння його основних норм є фундаментом до подальшої безпроблемною і успішного життя і діяльності. Отже, що таке с...
Принц Чарльз – головний спадкоємець британського престолу
Згідно із законом королівства Великобританія, спадкоємець британського престолу - це старший закононароджена син чинного монарха або ж попереднього претендента на престол. Однак якщо у царюючого особи немає дитини чоловічої статі, то право спадкуванн...
Перші підозри про те, що Демокрит насправді правий, з'явилися у хіміків. Вони швидко виявили, що багато речовини в ході реакцій розпадаються на більш прості компоненти. Крім того, саме хіміки вивели суворі закономірності цих процесів. Так, вони звернули увагу, що для отримання води потрібно вісім масових часткою кисню і одна - водню (закон Авогадро).
В Середні століття будь-матеріалістичне вчення, в тому числі і теорія Демокріта, поширення і розвитку одержати не могло в принципі. І тільки в XVIII столітті вчені знову повертаються до атомістичної теорії. До того часу хімік А. Лавуазьє, наш великий М. В. Ломоносов і талановитий англійський фізик Д. Дальтон (про який ми поговоримо окремо), вже переконливо довели своїм колегам реальність існування атомів. Слід підкреслити, що навіть в освіченому 18 столітті довгий час атомарна теорія багатьма видатними людьми того часу серйозно не розглядалася.
Як би там не було, але навіть ці великі вчені ще не висували теорій про будову самого атома, так як він вважався єдиною і неподільною часткою, основою всього сущого.
На жаль, хімічні досліди не могли наочно довести реальність перетворення атомів одних речовин в інші. Але все ж основоположною наукою у вивченні будови атомів стала саме хімія. Атоми і молекули тривалий час вивчалися одним геніальним російським вченим, без якого не можна уявити собі сучасну науку.
Вчення Д. І. Менделєєва
 Величезну роль у становленні атомарного вчення зіграв Д. І. Менделєєв, який ще в 1869 році створив свою геніальну періодичну систему. Вперше науковому співтовариству була представлена теорія, яка не тільки не відкидала, але і розумно доповнювала все припущення матеріалістів. Вже в 19 столітті вчені змогли довести існування електронів. Всі ці висновки змусили кращі уми 20-го століття серйозно вивчити атом. У хімії цей час також був ознаменований безліччю відкриттів.
Величезну роль у становленні атомарного вчення зіграв Д. І. Менделєєв, який ще в 1869 році створив свою геніальну періодичну систему. Вперше науковому співтовариству була представлена теорія, яка не тільки не відкидала, але і розумно доповнювала все припущення матеріалістів. Вже в 19 столітті вчені змогли довести існування електронів. Всі ці висновки змусили кращі уми 20-го століття серйозно вивчити атом. У хімії цей час також був ознаменований безліччю відкриттів.
Але вчення Менделєєва цінне не тільки цим. Досі залишається неясним, як саме формувалися атоми різних хімічних елементів. Але великий російський вчений зміг переконливо довести, що всі вони без винятку складаються в близькому спорідненні один з одним.
Відкриття Дальтона
Але зуміти інтерпретувати численні розрізнені дані зміг тільки Джон Дальтон, ім'я якого навіки закарбоване у відкритому ним самим законі. Зазвичай вчений досліджував тільки поведінка газів, але коло інтересів у нього був набагато ширше. У 1808 році він приступив до публікації своєї нової фундаментальної роботи.
Саме Дальтон припустив, що кожному хімічному елементу відповідає певний атом. Але вчений,як і Демокріт за багато століть до нього, все ж вважав, що вони є повністю неподільними. В його чернетках чимало схематичних малюнків, на яких атоми представлені у вигляді простих кульок. Ця ідея, що зародилася понад 2500 років тому, проіснувала майже до нашого часу! Втім, лише порівняно недавно було відкрито дійсно глибоке будова атома. Хімія (9 клас зокрема) навіть сьогодні багато в чому керується тими ідеями, які були вперше озвучені у 18 столітті.
Експериментальні підтвердження подільності атомів
Втім, до кінця 19 століття практично всі вчені вважали, що атом - та межа, за якою нічого немає. Вони думали, що основою всього світобудови є саме він. Цьому сприяли різні експерименти: як не крути, але змінювалися лише молекули, в той час як з самими атомами речовин не відбувалося рівним рахунком нічого, чого б не змогла пояснити найпростіша хімія. Будова атома вуглецю, наприклад, залишається незмінним навіть у різних аллотропних станах.
Словом, довгий час не було рівним рахунком ніяких експериментальних даних, які хоча б побічно підтверджували підозри деяких вчених про те, що є якісь більш фундаментальні частинки. Тільки в 19 столітті (не в останню чергу завдяки дослідам подружжя Кюрі) було доведено, що в певних умовах атоми одних елементів можуть перетворюватися в інші. Ці відкриття лягли в основу сучасних уявлень про навколишній нас світі.
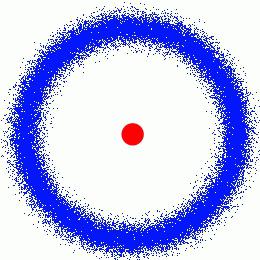
Родзинки і пудинги
В 1897 році Дж. Томсоном, англійським фізиком, було встановлено, що в будь-якому атомі є певна кількість негативно заряджених частинок, які він назвав «електронами». Вже в 1904 році вчений створив першу атомарну модель, яка більш відома під назвою «пудинг з родзинками». Назва цілком точно відображає суть. Судячи з теорії Томсона, атом у хімії – це певний «посудину» з рівномірно розподіленими в ньому зарядом і електронами.
Зауважимо, що подібна модель мала ходіння навіть у 20-му столітті. Згодом виявилося, що вона була абсолютно неправильною. Але все ж це була перша усвідомлена спроба людини (причому на науковій основі) відтворити навколишній його мікросвіт, запропонувавши модель атома, досить просту і наочну.
Досліди Кюрі
Прийнято вважати, що подружжя П'єр та Марія Кюрі поклали початок атомній фізиці. Звичайно ж, внесок цих геніальних людей, фактично пожертвували своїм здоров'ям і життям, не можна недооцінити, але їх досліди мали куди більш фундаментальне значення. Практично одночасно з Резерфордом вони довели, що атом – набагато більш складна і різнорідна структура. Саме явище радіоактивності, яке вони досліджували, саме про це і говорив.
 Вже на початку 1898 року Марія публікує першу статтю, присвячену радіації. Незабаром Марія і П'єр Кюрі довели, що в суміші хлористих сполук урану і радію починають з'являтися інші речовини, в існуванні яких сумнівалася офіційна хімія. Будова атома з тих пір почали досліджувати впритул.
Вже на початку 1898 року Марія публікує першу статтю, присвячену радіації. Незабаром Марія і П'єр Кюрі довели, що в суміші хлористих сполук урану і радію починають з'являтися інші речовини, в існуванні яких сумнівалася офіційна хімія. Будова атома з тих пір почали досліджувати впритул.
«Планетарний» підхід
Нарешті Резерфорд вирішив провести бомбардування атомів важких металів α-частинками (повністю іонізований гелій). Учений відразу ж припустив, що легкі електрони ніяк не зможуть змінити траєкторію руху частинок. Відповідно, розсіювання можуть викликати тільки якісь більш важкі елементи, які можуть міститися в ядрі атома. Відразу зауважимо, що спочатку Резерфорд ніяк не претендував на зміну теорії «пудингу». Ця модель атома вважалася бездоганною.
А тому результат, при якому майже всі частинки без проблем проходили через тонкий шар срібла, його не здивував. Ось тільки незабаром з'ясувалося, що деякі атоми гелію відхилялися відразу на 30°. Це було зовсім не те, про що говорила в той час хімія. Склад атома по Томсону припускав рівномірний розподіл електронів. Але цього явно суперечили спостережувані явища.
Надзвичайно рідко, але все ж деякі частинки відлітали під кутом навіть 180°. Резерфорд був у глибокому подиві. Адже це різко суперечило «пудингу», заряд в якому повинен був бути (по теорії Томсона) розподілено рівномірно. Отже, нерівномірно заряджені ділянки, які могли б відштовхувати іонізований гелій, повинні були бути відсутнім.
До яких висновків прийшов Резерфорд?
Ці обставини і наштовхнули на думку вченого, що атом практично порожній і тільки в центрі зосереджено якусь освіту з позитивним зарядом - ядро. Так і виникла планетарна модель атома, постулати якої наступні:
- Як ми вже говорили, в центральній частині розташоване ядро, причому його обсяг (по відношенню до розміру самого атома) мізерно малий.
- Практично вся атомарна маса, а також весь позитивний заряд знаходяться саме в ядрі.
- Навколо нього обертаються електрони. Важливо, що їх число дорівнює значенню позитивного заряду.
Парадокси теорії
 Все було б добре, але дана модель атома ніяк не пояснює їх неймовірну стійкість. Слід пам'ятати, що електрони рухаються по своїх орбітах з величезним прискоренням. За всіма законами електродинаміки такий об'єкт з часом повинен втратити свій заряд. Якщо брати до уваги постулати Ньютона і Максвелла, тоелектрони взагалі повинні сипатися на ядро, немов град на землю.
Все було б добре, але дана модель атома ніяк не пояснює їх неймовірну стійкість. Слід пам'ятати, що електрони рухаються по своїх орбітах з величезним прискоренням. За всіма законами електродинаміки такий об'єкт з часом повинен втратити свій заряд. Якщо брати до уваги постулати Ньютона і Максвелла, тоелектрони взагалі повинні сипатися на ядро, немов град на землю.
Звичайно, нічого такого в реальності не відбувається. Будь атом не тільки абсолютно стійкий, але і може існувати абсолютно необмежений час, причому ніякого випромінювання від нього йти не буде. Така невідповідність пояснюється тим, що до мікросвіту ми намагаємося застосовувати закони, які дійсні лише щодо класичної механіки. Вони ж, як виявилося, до явищ атомарного масштабу абсолютно незастосовні. А тому будова атома (хімія, 11 клас) автори підручників намагаються пояснити як можна більш простими словами.
Вчення Бору
Датським фізиком Нільсом Бором було доведено, що на мікросвіт не можна поширювати ті ж закони, положення яких справедливі для макроскопічних об'єктів. Саме йому належить ідея про те, що мікросвіт «керується» виключно квантовими законами. Звичайно, тоді не існувало самої квантової теорії, але Бор фактично став її родоначальником, висловивши свої думки у вигляді трьох постулатів, які «рятували» атом, неминуче б загиблий, якщо б він «жив» згідно теорії Резерфорда. Саме ця теорія данця лягла в основу всієї квантової механіки.
Постулати Бора
- Перший з них говорить: будь-яка атомна система може перебувати тільки в особливих атомних станах, причому для кожного з них характерне певне значення енергії (Е). Якщо стан атома стаціонарне (спокійний), то випромінювати він не може.
- Другий постулат говорить про те, що випромінювання світлової енергії відбувається тільки в разі переходу з стану з більшою енергією в більш помірне. Відповідно, виділювана енергія дорівнює різниці значень між двома стаціонарними станами.
Модель атома Нільса Бора
Цю полуклассическую теорію вчений запропонував у 1913 році. Примітно, що в її основу він поклав планетарну модель Резерфорда, який незадовго до нього описав атом речовини. Ми вже говорили, що класична механіка суперечила викладенням Резерфорда: виходячи з неї, передбачалося, що з часом електрон повинен був обов'язково впасти на поверхню атома.
«обійти» це протиріччя, вчений ввів спеціальне допущення. Його суть полягала в тому, що випромінювати енергію (що і повинно було приводити до їх падіння) електрони можуть, лише рухаючись по певних орбітах. При русі ж їх за іншими траєкторіями, нібито хімічні атоми залишалися в пасивному стані. Згідно з теорією Бора такими орбітами були ті, кількісний момент руху по яким був дорівнює постійним Планка.
Квантова теорія будови атома
 Як ми вже говорили, на сьогоднішній день в ходу квантова теорія будови атома. Хімія останніх років керується виключно нею. В її основі лежать чотири основні аксіоми.
Як ми вже говорили, на сьогоднішній день в ходу квантова теорія будови атома. Хімія останніх років керується виключно нею. В її основі лежать чотири основні аксіоми.
1. По-перше, подвійність (корпускулярно-хвильова природа) самого електрона. Простіше кажучи, веде себе ця частинка і як матеріальний об'єкт (корпускула), і як хвиля. Як частинка він має певний заряд і масу. Здатність до дифракції ріднить електрони з класичними хвилями. Довжина цієї хвилі (λ) і швидкість частинки (v) можуть бути пов'язані один з одним спеціальним співвідношенням де Бройля: λ = h / mv. Як можна здогадатися, m – маса самого електрона.
2. Координату і швидкість частинки заміряти з абсолютною точністю неможливо. Чим точніше визначається координата, тим вище невизначеність швидкості. Як, втім, і навпаки. Це явище отримало назву невизначеності Гейзенберга, яке може бути виражене у вигляді наступного співвідношення: ∆x∙m∙∆v > ћ/2. Дельта Х (∆х) виражає невизначеність положення координати в просторі. Відповідно, дельта V (∆v) відображає швидкісні похибки.
3. Всупереч усім раніше поширеним думкам, електрони не проходять по строго визначених орбітах, як поїзда по рейках. Квантова теорія говорить, що електрон може перебувати в будь-якій точці простору, але ймовірність цього є різна для кожного відрізка.
Та частина простору навколо безпосередньо атомного ядра, у якій ця ймовірність максимальна, називається орбиталью. Сучасна хімія будова електронних оболонок атомів вивчає саме з цієї точки зору. Звичайно, у школах вчать правильному розподілу електронів по рівнях, але, по всій видимості, в реальності вони розходяться зовсім інакше.
4. Ядро атома складається з нуклонів (протонів і нейтронів). Порядковий номер елемента в періодичній системі вказує на кількість протонів в його ядрі, а сума протонів і нейтронів дорівнює атомарної масі. Ось як пояснює будову ядра атома хімія сучасності.
Основоположники квантової механіки
 Відзначимо тих вчених, які внесли найбільший внесок у розвиток такої важливої галузі: французький фізик Л. де Бройль, німець Ст. Гейзенберг, австрієць Е. Шредінгер, англієць П. Дірак. Всі ці люди згодом були удостоєні Нобелівської премії.
Відзначимо тих вчених, які внесли найбільший внесок у розвиток такої важливої галузі: французький фізик Л. де Бройль, німець Ст. Гейзенберг, австрієць Е. Шредінгер, англієць П. Дірак. Всі ці люди згодом були удостоєні Нобелівської премії.
Як же далеко в цьому плані пішла хімія? Будова атома більшість хіміків тих років вважали досить простим: багато хто тільки до 1947 році остаточно визнали реальність існування елементарних частинок.
Деякі висновки
Взагалі, при створенні квантової теорії не обійшлося без математиків, так як всі ці процеси можна розрахувати тільки з використаннямскладних обчислень. Але найголовніша трудність полягає зовсім не в цьому. Ті процеси, які описуються теорією, недоступні не тільки нашим органам почуттів, незважаючи на всю сучасну наукову техніку, але й уяві.
Ні один чоловік навіть приблизно не може уявити собі процеси в мікросвіті, так як вони абсолютно не схожі на всі ті явища, які ми спостерігаємо в макросвіті. Вдумайтеся тільки: останні відкриття дають привід припускати, що кварки, нейтрино і інші фундаментальні частинки існують в девятимерном (!) вимірі. Як людина, яка живе в тривимірному просторі, може навіть приблизно описувати їх поведінку?
зараз нам залишається лише сподіватися на математику і потужність сучасних комп'ютерів, які, можливо, будуть використані для моделювання мікросвіту. Відчутно допомагає і хімія: будова атома, напевно, буде переглянуто, після того як нещодавно науковці, які працюють у цій області, повідомили про відкриття нового типу хімічного зв'язку.
Сучасне уявлення про будову атома
Якщо ви уважно прочитали все вищевикладене, то напевно і самі зможете сказати, яке сьогоднішнє уявлення про будову атомів речовин. Але все ж ми пояснимо: це дещо видозмінена теорія Резерфорда, доповнена безцінними постулатами Нільса Бора. Простіше кажучи, сьогодні вважається, що електрони рухаються по хаотичним, розмитим траєкторіях біля ядра, яке складається з нейтронів і протонів. Та частина простору навколо нього, в якій поява електрона найбільш ймовірно, називають орбиталью.
Поки не представляється можливим точно сказати, як будуть змінюватися наші уявлення про будову атома надалі. Щодня вчені працюють над проникненням в таємниці мікросвіту: БАК (Великий андронний коллайдер), Нобелівські премії в області фізики – все це є результатом даних досліджень.
Але навіть зараз ми не уявляємо і приблизної картини того, що ще приховують атоми. Зрозуміло лише, що сам атом в масштабах мікросвіту – величезний багатоквартирний будинок, в якому нами обстежений хіба що перший поверх, та й то не повністю. Практично щороку з'являються повідомлення про можливість відкриття все нових і нових елементарних частинок. Коли процес дослідження атомів буде повністю закінчено, сьогодні спрогнозувати не візьметься ніхто.
 Досить сказати, що наші уявлення про них почали змінюватися тільки з 1947 року, коли були відкриті так звані V-частинки. До цього люди лише трохи поглибили теорії, на яких з 19 століття ґрунтувалася хімія. Будова атома – захоплююча загадка, розгадуванням якої зайняті кращі уми людства.
Досить сказати, що наші уявлення про них почали змінюватися тільки з 1947 року, коли були відкриті так звані V-частинки. До цього люди лише трохи поглибили теорії, на яких з 19 століття ґрунтувалася хімія. Будова атома – захоплююча загадка, розгадуванням якої зайняті кращі уми людства.
Article in other languages:
BE: https://tostpost.com/be/adukacyya/33083-atam-u-h-m---geta-madel-atama-budova-atama.html
KK: https://tostpost.com/kk/b-l-m/33409-atom-himiya---b-l-model-atom-fizikasy-atom-rylysy.html
PL: https://tostpost.com/pl/edukacja/34457-atom-w-chemii---to-model-atomu-budowa-atomu.html
TR: https://tostpost.com/tr/e-itim/29835-atom-kimya-atom-modeli-atomun-yap-s.html

Alin Trodden - автор статті, редактор
"Привіт, Я Алін Тродден. Я пишу тексти, читаю книги і шукаю враження. І я непогано вмію розповідати вам про це. Я завжди радий брати участь у цікавих проектах."
Новини
Куди може привести безперервна освіта
З народження до смерті людині доводиться постійно вчитися для того, щоб вижити, щоб пристосуватися до мінливої дійсності, щоб знайти і пізнати самого себе і розумно прожити своє життя. Концепція безперервної освіти, навчання, само...
Вступний оборот. Ввідні слова, словосполучення і речення. Постановка розділових знаків
У своїй промові люди досить часто використовують вступні конструкції, щоб показати своє ставлення до того, про що саме вони розповідають. При написанні вступний оборот обов'язково виділяється комами, а в усному мовленні такий обор...
На якій річці стоїть Казань. Природні пам'ятки Казані
Казань – столиця Татарстану. Місто володіє тисячолітньою історією, самобутньою культурою, розвиненою економікою, є науковим центром республіки. На його території розташований великий порт. На якій річці стоїть Казань –...
Ким був перший винахідник радіо?
А. С. Попов - винахідник радіо, яким по праву може пишатися наша країна. Він першим почав вивчати електромагнітні хвилі, і навіть був викладачем відповідних курсів для офіцерів. Саме Попов знайшов практичне застосування электровол...
Антоніми – це протиставлені один одному за змістом, але належать до однієї і тієї ж частини мови слова. Вони мають різне написання і звучання. Визначити значення одного антоніма дуже просто через інший, досить йому надати фо...
ЗМІ: лексичне значення слова, синоніми і тлумачення
Складність визначення лексичного значення слова «ЗМІ» в тому, що словник дає тільки розшифровку абревіатури. Тому більш повне розуміння терміна доведеться сформулювати самим, також розглянемо синоніми і тлумачення поня...






















Примітка (0)
Ця стаття не має коментарів, будьте першим!