Das Atom in der Chemie ist... ein Modell des atoms. Struktur des atoms
Gedanken über das Wesen der gesamten Umgebung begann frequentieren die Menschheit schon lange Blütezeit der modernen Zivilisation. Zuerst die Menschen haben über die Existenz von einigen der höheren Kräfte, die, wie Sie glaubten, предопределяли alle Dasein. Aber schon ziemlich bald die Philosophen und Priester haben begonnen, darüber nachzudenken, aus was besteht denn eigentlich selbst den Stoff des Daseins. Theorien gab es viele, aber in der historischen Perspektive dominant geworden ist atomar.
 Was ist in der Chemie ein Atom? Diese, sowie alle damit verbundenen Themen diskutieren wir im Rahmen dieses Artikels. Wir hoffen, dass in Ihr finden Sie die Antworten auf alle Ihre Fragen.
Was ist in der Chemie ein Atom? Diese, sowie alle damit verbundenen Themen diskutieren wir im Rahmen dieses Artikels. Wir hoffen, dass in Ihr finden Sie die Antworten auf alle Ihre Fragen.
Der Stammvater der atomaren Theorie
Womit beginnt die erste Lektion der Chemie? Struktur des atoms – das ist das Hauptthema. Erinnern Sie sich sicherlich, dass das Wort „Atom» übersetzt aus dem altgriechischen Sprache wie „unteilbare». Jetzt viele Historiker glauben, dass der erste die Theorie auf, гласившую über einige der kleinsten Teilchen, aus denen sich alle Dinge, Demokrit. Er lebte im fünften Jahrhundert vor unserer Zeitrechnung.
Leider von dieser einzigartigen мыслителе fast nichts bekannt. Vor uns kam noch eine schriftliche Quelle aus jener Zeit. Und weil die Ideen der größten Wissenschaftler seiner Zeit müssen wir erkennen ausschließlich aus den Werken von Aristoteles, Platon und anderen griechischen Denkern.
Also, unser Thema ist "Aufbau des atoms". In der Chemie hatten nicht alle Noten, aber viele erinnern sich daran, dass alle Erkenntnisse der antiken Gelehrten wurden ausschließlich auf die Argumentation. Demokrit die Ausnahme nicht war.
Wie begründete Demokrit?
Seine Logik war sehr einfach, aber zugleich genial. Stellen Sie sich vor, dass Sie die scharfen Messer in der ganzen Welt. Sie nehmen einen Apfel, zum Beispiel, und dann starten Sie es geschnitten: in zwei Hälften, in Viertel schneiden, Sie wieder zu teilen... Kurz, früher oder später erhalten Sie die Scheibe so unglücklich Stärke, was als Nächstes teilen Sie bereits unmöglich sein. Das ist also das unteilbare Atom. In der Chemie ist diese Aussage galt als wahrer fast bis zum Ende des 19 Jahrhunderts.
Von Demokrit zur modernen Vorstellungen
Es ist zu beachten, dass von den griechischen Vorstellungen über den Mikrokosmos erhalten geblieben ist nur ein Wort „Atom». Jetzt weiß jeder Schüler, dass die uns umgebende Welt besteht aus viel mehr Grundlagenforschung und kleine Partikel. Darüber hinaus aus der Sicht der modernen Wissenschaft die Theorie des Demokrit war nicht mehr als eine rein hypothetische auslegen, nicht verstärkter absolut keinen beweisen. Doch in jenen Tagen gab es Elektronenmikroskope, so seine Unschuld zu beweisen auf andere Weise bei einem Denker würde immer noch nicht funktioniert.
Mehr:
Das Deutsche Flugzeug "Messerschmitt-262": die Geschichte der Entstehung, Merkmale, Foto
High-Speed-Strahltriebwerk-Kämpfer-Abfangjäger Messerschmitt ME-262 Schwalbe („Messerschmitt ME-262 Schwalbe») erschien auf dem Schlachtfeld nur im Jahr 1944. Man kann nicht genau sagen, für welchen Job diese Maschine bestimmt. Experiment...
Moderne Schule: Geschichte, Voraussetzungen, Probleme. Modelle der modernen Schulen
Historische Entstehung von Schulen förderte den Wunsch der Menschen die Welt zu erkennen und erweitern Ihre Kenntnisse. Deshalb versucht der Mensch zur Gemeinschaft mit den weisen und sehnte sich danach von Ihnen zu lernen wissen.die Geschichte der m...
"Haare zu Berge": Bedeutung, Herkunft фразеологизма
In der Russischen Sprache treffen eine ausreichende Anzahl von geheimnisvollen Floskeln, über deren Bedeutung schwer zu erraten. Die sprachliche Konstruktion „die Haare» gehört eindeutig zu den solchen. Zum Glück, der Ursprung dieses Ausd...
Der Erste Verdacht, dass Demokrit eigentlich Recht, gab es bei den Chemikern. Sie stellten schnell fest, dass viele Substanzen während der Reaktion zerfallen in kleinere Komponenten. Darüber hinaus ist es die Chemiker brachten die strenge Gesetzmäßigkeit dieser Prozesse. So, Sie haben darauf geachtet, dass für den Erhalt von Wasser benötigt acht massiven Anteil von Sauerstoff und Wasserstoff (Gesetz von Avogadro).
Im Mittelalter jede materialistische Lehre, einschließlich der Theorie des Demokrit, der Verbreitung und Entwicklung erhalten könnte nicht im Prinzip. Und nur in dem XVIII Jahrhundert die Wissenschaftler wieder атомистической Theorie. Bis dahin Chemiker A. Lavoisier, unser großer M. V. Lomonosov und talentvolle der englische Physiker D. Dalton (über die wir GESONDERT zu sprechen), bereits überzeugend bewiesen Ihre Kollegen die Realität der Existenz von Atomen. Es sollte betont werden, dass auch im aufgeklärten 18. Jahrhundert lange Zeit der atomaren Theorie von vielen prominenten Köpfen der damaligen Zeit ernsthaft in Betracht gezogen worden.
Wie dem auch sei, aber auch diese großen Gelehrten noch nicht vorangebracht Theorien über die Struktur des atoms, da galt er als einer einheitlichen und unteilbaren Teilchen, die Grundlage aller Dinge.
Leider, Chemische Experimente konnten belegen eindeutig die Realität der Umwandlung von Atomen bestimmte Stoffe in andere. Aber alle die gleichen grundlegenden Wissenschaft in der Studie der Struktur der Atome wurde gerade die Chemie. Atome und Moleküle lange Zeit untersucht eine geniale russische Wissenschaftler, ohne die es unmöglich vorstellen, die die moderne Wissenschaft.
Lehre Mendelejew
 Eine Große Rolle in der Entwicklung der Lehre von atomarem spielte D. I. Mendelejew, der noch im Jahre 1869 gründete seine geniale Periodensystem. Zum ersten mal wissenschaftlichen Gemeinschaft vorgestellt wurde eine Theorie, die nicht nur nicht abgestritten, aber sinnvoll ergänzen alle Annahmen der Materialisten. Bereits im 19 Jahrhundert konnten die Wissenschaftler beweisen die Existenz von Elektronen. Alle diese Erkenntnisse zwangen die besten Köpfe des 20. Jahrhunderts ernsthaft zu studieren Atom. In der Chemie dieser Zeit wurde auch eingeläutet vielen Entdeckungen.
Eine Große Rolle in der Entwicklung der Lehre von atomarem spielte D. I. Mendelejew, der noch im Jahre 1869 gründete seine geniale Periodensystem. Zum ersten mal wissenschaftlichen Gemeinschaft vorgestellt wurde eine Theorie, die nicht nur nicht abgestritten, aber sinnvoll ergänzen alle Annahmen der Materialisten. Bereits im 19 Jahrhundert konnten die Wissenschaftler beweisen die Existenz von Elektronen. Alle diese Erkenntnisse zwangen die besten Köpfe des 20. Jahrhunderts ernsthaft zu studieren Atom. In der Chemie dieser Zeit wurde auch eingeläutet vielen Entdeckungen.
Aber die Lehre von Mendelejew nicht nur wertvoll. Bisher bleibt unklar, wie genau es bildeten sich die Atome der verschiedenen chemischen Elemente. Aber der große russische Wissenschaftler war in der Lage, schlüssig zu beweisen, dass Sie alle ohne Ausnahme bestehen in der nahen Verwandtschaft mit einander.
Öffnen daltona
Aber in der Lage zu interpretieren mehrfache vereinzelte Daten konnte nur John Dalton, dessen name für immer eingeprägt in der offenen, Sie selbst sind Gesetz. In der Regel Wissenschaftler untersuchten nur das Verhalten der Gase, sondern das Spektrum von Interessen bei ihm war viel breiter. Im Jahre 1808 begann er mit der Veröffentlichung seiner neuen fundamentalen Arbeit.
Genau Dalton schlug vor, dass jedem chemischen Element entspricht ein bestimmtes Atom. Aber der Wissenschaftler,wie Demokrit für viele Jahrhunderte vor ihm, dennoch glaubte, dass Sie sind völlig untrennbar sind. In seinen Entwürfen eine Menge schematischen Zeichnungen, auf denen die Atome werden als einfache Kugeln. Diese Idee, die vor über 2500 Jahren, dauerte fast bis in unsere Zeit! Doch nur verhältnismäßig vor kurzem geöffnet war wirklich eine Tiefe Struktur des atoms. Chemie (Klasse 9 insbesondere) auch heute noch in vielerlei Hinsicht richtet sich nach den Ideen, die wurden der öffentlichkeit erstmals im 18.
Experimentelle Bestätigung der Teilbarkeit der Atome
Übrigens, bis zum Ende des 19 Jahrhunderts fast alle Wissenschaftler glaubten, dass die Atom - jener Grenze, jenseits derer es nichts gibt. Sie dachten, dass die Grundlage der gesamten Schöpfung ist er. Dazu trugen verschiedene Experimente: wie auch immer, sondern verändert nur die Moleküle, während Sie mit den Atomen der Stoffe nicht geschah gar nichts, was ich nicht erklären konnte einfachste Chemie. Struktur des atoms des Kohlenstoffs, zum Beispiel, bleibt völlig unverändert auch in verschiedenen allotropen Zuständen.
Kurz gesagt, lange Zeit gab es gar keine experimentellen Daten vor, die zumindest indirekt bestätigt den Verdacht einiger Wissenschaftler, dass es einige weitere fundamentale Teilchen. Erst im 19 Jahrhundert (nicht zuletzt durch die Erfahrungen der Eheleute Curie) wurde bewiesen, dass unter bestimmten Bedingungen der Atome einiger Elemente können sich in eine andere. Diese Entdeckung bildete die Grundlage der modernen Vorstellungen über die Welt.
Rosinen und Pudding
Im J. 1897. Thomson, englischer Physiker, wurde festgestellt, dass in jedem Atom gibt es eine Anzahl von negativ geladenen Teilchen, die er nannte die „Elektronen». Bereits im Jahr 1904 Wissenschaftler schuf die erste Ordnungszahl Modell, das besser bekannt ist unter der Bezeichnung „Pudding mit Rosinen». Der Titel ziemlich genau den Kern. Gemessen an der Theorie von Thomson, das Atom in der Chemie – ein „Schiff“ mit gleichmäßig darin verteilten Ladung und Elektronen.
Beachten Sie, dass ein solches Modell hatte der Wandel auch im 20. Jahrhundert. Später stellte sich heraus, dass es war völlig falsch. Doch es war der erste bewusste Versuch des Menschen (wobei auf wissenschaftlicher Grundlage) neu die Welt um ihn Mikrokosmos, indem Sie das Modell des atoms, eine ziemlich einfache und anschauliche.
Erfahrungen Curie
Es wird Angenommen, dass die Eheleute Pierre und Marie Curie markierte den Beginn der Atomphysik. Natürlich, der Beitrag dieser genialen Menschen tatsächlich Spender, Ihre Gesundheit und Ihr Leben, darf man nicht unterschätzen, aber Ihre Erfahrungen hatten und viel mehr von grundlegender Bedeutung. Fast gleichzeitig mit Резерфордом haben Sie bewiesen, dass Atom – viel mehr als eine komplexe und heterogene Struktur. Das Phänomen der Radioaktivität, die Sie erforschten, und genau darüber geredet.
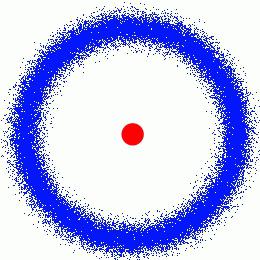 Bereits am Anfang des Jahres 1898 Maria veröffentlicht den ersten Artikel gewidmet Strahlung. Bald Marie und Pierre Curie haben bewiesen, dass in der Mischung von Chlorverbindungen Uran und Radium andere Stoffe beginnen zu erscheinen, in deren Existenz zweifelte die offizielle Chemie. Struktur des atoms seitdem begonnen, zu erforschen dicht.
Bereits am Anfang des Jahres 1898 Maria veröffentlicht den ersten Artikel gewidmet Strahlung. Bald Marie und Pierre Curie haben bewiesen, dass in der Mischung von Chlorverbindungen Uran und Radium andere Stoffe beginnen zu erscheinen, in deren Existenz zweifelte die offizielle Chemie. Struktur des atoms seitdem begonnen, zu erforschen dicht.
„der Planetarische» Ansatz
Schließlich Rutherford beschlossen produzieren Bombardement der Atome Schwermetalle α-Teilchen (vollständig ionisierte Helium). Der Wissenschaftler sofort spekuliert, dass die leichten Elektronen nicht in der Lage, ändern Sie die Flugbahn der Bewegung der Teilchen. Dementsprechend Streuung verursachen nur einige schwerere Elemente, die möglicherweise im Kern eines atoms. Sofort werden wir bemerken, dass zunächst Rutherford keinen Anspruch auf änderung der Theorie „Pudding». Dieses Modell des atoms als einwandfreie.
Und weil das Ergebnis, bei dem fast alle Partikel ohne Probleme gingen durch eine dünne Schicht aus Silber, überraschte ihn nicht. Das ist nur bald stellte sich heraus, dass einige Heliumatome sofort abgelehnt bei 30°. Es war nicht ganz das, was ich sagte, während die Chemie. Die Zusammensetzung des atoms beim Thomson vermutete eine gleichmäßige Verteilung von Elektronen. Aber es ausdrücklich widersprochen die beobachteten Phänomene.
Extrem selten, aber immer noch einige Partikel weggegangen sogar unter dem Winkel 180°. Rutherford war in den tiefsten Verlust. Weil es heftig widersprach „пудингу», die Ladung in dem sein sollte (nach Thomsons Theorie) gleichmäßig verteilt. Daher ungleichmäßig geladene Bereiche, die Sie abstoßen könnten ionisiertes Helium, sollten nicht vorhanden sein.
Zu welchen Schlussfolgerungen kam Rutherford?
Diese Umstände führten Wissenschaftler auf die Idee, dass das Atom praktisch leer ist und nur in der Mitte konzentriert Aufwölbung mit einer positiven Ladung - Kern. So entstand das planetenmodell des atoms, Postulate der folgenden:
- Wie wir schon sagten, im zentralen Teil befindet sich ein Kern, wobei das Volumen (im Verhältnis zur Größe des atoms) vernachlässigbar ist.
- Fast alle atomaren Masse sowie die gesamte positive Ladung befinden sich genau im Kern.
- Um ihn Herum Kreisen Elektronen. Es ist wichtig, dass Ihre Zahl gleich dem Wert der positiven Ladung.
Die Paradoxe Theorie
 Alles wäre gut, aber dieses Modell des atoms nicht erklärt Ihre unglaubliche Stabilität. Beachten Sie, dass die Elektronen bewegen sich auf Ihren Umlaufbahnen mit einer enormen Beschleunigung. Nach allen Gesetzen der Elektrodynamik ein solches Objekt muss mit der Zeit verlieren Ihre Ladung. Wenn unter Berücksichtigung der Postulate von Newton und Maxwell, die Elektronen müssen im Allgemeinen zerfallen auf den Kern, wie Hagel auf die Erde.
Alles wäre gut, aber dieses Modell des atoms nicht erklärt Ihre unglaubliche Stabilität. Beachten Sie, dass die Elektronen bewegen sich auf Ihren Umlaufbahnen mit einer enormen Beschleunigung. Nach allen Gesetzen der Elektrodynamik ein solches Objekt muss mit der Zeit verlieren Ihre Ladung. Wenn unter Berücksichtigung der Postulate von Newton und Maxwell, die Elektronen müssen im Allgemeinen zerfallen auf den Kern, wie Hagel auf die Erde.
Natürlich nichts in der Realität nicht vorkommt. Jedes Atom nicht nur absolut robust, sondern auch existieren kann, völlig unbegrenzt, wobei keine Strahlung von ihm nicht gehen wird. Diese Diskrepanz erklärt sich dadurch, dass die микромиру wir versuchen, gelten die Gesetze, die gelten nur in Bezug auf die klassische mechanik. Sie aber wie sich herausstellte, zu den Phänomenen der atomaren Skala nicht ganz. Und weil die Struktur des atoms (Chemie, Klasse 11) die Autoren der Lehrbücher versuchen zu erklären wie möglich in einfachen Worten.
Lehre Bor
Von dem Dänischen Physiker Niels Bohr wurde bewiesen, dass der Mikrokosmos nicht weitergegeben werden, die gleichen Gesetze und Bestimmungen gelten für die makroskopischen Objekten. Genau dazu gehört die Vorstellung, dass der Mikrokosmos „geführt“, die ausschließlich den Gesetzen der Quanten. Natürlich gab es damals nicht die Quantentheorie, sondern tatsächlich Bor wurde Ihr Stammvater, äußern Ihre Gedanken in Form von drei Postulate, die „gerettet» Atom, würde unweigerlich verloren, wenn er „lebte» nach der Theorie von Rutherford. Genau diese Theorie DANE Grundlage für den gesamten Quantenmechanik.
Postulate Bora
- Die Erste lautet: jedes Atomare System kann sich nur in besonderen atomaren Zuständen, wobei für jeden von Ihnen ist charakteristisch für einen bestimmten Wert der Energie (E). Wenn der Zustand des atoms stationäre (ruhig), dann emittieren kann es nicht.
- Zweite Postulat besagt, dass die Emission von Lichtenergie erfolgt nur im Falle des übergangs von einem Zustand mit höherer Energie in mehr als Moderat. Dementsprechend freigesetzte Energie gleich der Differenz der Werte zwischen zwei stationären Zuständen.
Atom-Modell von Niels Bohr
Diese полуклассическую Theorie der Wissenschaftler schlug vor, im Jahr 1913. Es ist bemerkenswert, dass in Ihr die Grundlage legte er planetarische Modell von Rutherford, der kurz vor ihm beschrieb Atom der Materie. Wir haben bereits gesagt, dass die klassische mechanik widersprach Berechnungen Rutherford: ausgehend von Ihr, wird es angenommen, dass das Elektron mit der Zeit musste zwangsläufig fallen auf die Oberfläche des atoms.
Um die „umgehen» es ist ein Widerspruch, der Gelehrte führte eine spezielle Zulassung. Sein Wesen Bestand darin, dass die Energie emittieren (das sollte bewirken, dass Sie herunterfallen) können Elektronen, bewegt sich nur auf bestimmten Bahnen. Bei der Bewegung aber auch andere Bahnen angeblich die chemischen Atome blieben im passiven Zustand. Nach der Theorie von Bor als solche Umlaufbahnen waren diejenigen, quantitative Moment der Bewegung, die war gleich Planck-Konstante.
Struktur der Quantentheorie des atoms
 Wie wir bereits gesagt haben, heute im Zuge der Quanten-Theorie des Baus des atoms. Chemie der letzten Jahre richtet sich ausschließlich von Ihr. Es basiert auf den vier grundlegenden Axiome.
Wie wir bereits gesagt haben, heute im Zuge der Quanten-Theorie des Baus des atoms. Chemie der letzten Jahre richtet sich ausschließlich von Ihr. Es basiert auf den vier grundlegenden Axiome.
1. Erstens, die Dualität (Welle-Teilchen-Welle-Natur) des Elektrons. Einfach ausgedrückt, verhält sich diese Partikel und wie ein materielles Objekt (corpuscule), und wie eine Welle. Wie ein Teilchen, er hat eine bestimmte Ladung und Masse. Die Fähigkeit zur gleichen Beugung von Elektronen gemeinsam mit klassischen Wellen. Die Länge dieser Wellen (λ) und die Geschwindigkeit des Teilchens (v) können miteinander verbunden werden Besondere Verhältnis von de Broglie: λ = h / mv. Wie Sie sich vorstellen können, m ü Masse des Elektrons.
2. Die Koordinate und die Geschwindigkeit der Partikel Messen mit einer absoluten Genauigkeit ist völlig unmöglich. Je genauer die Koordinate definiert ist, desto höher ist die Unbestimmtheit in der Geschwindigkeit. Wie übrigens auch Umgekehrt. Dieses Phänomen wird als der heisenbergsche Unschärferelation, die ausgedrückt werden kann in Form der folgenden Beziehung: ∆x∙m∙∆v > ž/2. Delta X (∆x) drückt die Unsicherheit der Position der Koordinaten im Raum. Dementsprechend Delta V (∆v) zeigt die High-Speed-Fehler.
3. Im Gegensatz zu allen früher landläufigen Meinung, die Elektronen gehen nicht auf streng definierten Bahnen, wie Züge auf Schienen. Die Quantentheorie besagt, dass das Elektron kann sich in einem beliebigen Punkt des Raumes, aber die Wahrscheinlichkeit dafür ist unterschiedlich für jeden Schnitt.
Der Teil des Raumes um direkt auf den Atomkern, in dem diese Wahrscheinlichkeit maximal ist, nennt man Orbital. Die moderne Chemie die Struktur der Elektronenhülle der Atome untersucht aus dieser Sicht. Natürlich in den Schulen lehren die korrekte Verteilung der Elektronen durch die Levels, aber offenbar in der Realität unterscheiden Sie sich ganz anders.
4. Atomkern besteht aus Nukleonen (Protonen und Neutronen). Die Ordnungszahl des Elements im periodischen System gibt die Anzahl der Protonen in seinem Kern, und die Summe der Protonen und Neutronen ist gleich der atomaren Masse. Hier ist, wie erklärt die Struktur der Kern eines atoms Chemie der Gegenwart.
Die Gründer der Quantenmechanik
 Beachten Sie jene Wissenschaftler, die den größten Beitrag geleistet haben zur Entwicklung der so wichtigen Branche: der französische Physiker L. de Broglie, deutscher W. Heisenberg, der österreicher E. Schrödinger, der Engländer P. dirac. Alle diese Menschen wurden später mit dem Nobelpreis ausgezeichnet.
Beachten Sie jene Wissenschaftler, die den größten Beitrag geleistet haben zur Entwicklung der so wichtigen Branche: der französische Physiker L. de Broglie, deutscher W. Heisenberg, der österreicher E. Schrödinger, der Engländer P. dirac. Alle diese Menschen wurden später mit dem Nobelpreis ausgezeichnet.
Wie weit in dieser Hinsicht gegangen Chemie? Struktur des atoms die meisten Chemiker jener Jahre glaubten einfach genug: viele nur auf das Jahr 1947 schließlich erkannten die Realität der Existenz der Elementarteilchen.
Einige Ergebnisse
Im Allgemeinen, bei der Schaffung der Quantentheorie nicht ohne Mathematiker, da alle diese Prozesse können nur mit dem berechnenkomplexe Berechnungen. Aber die größte Schwierigkeit ist nicht der Punkt. Die Prozesse, die beschreibt dieser Theorie, nicht nicht nur unseren Sinnen, trotz aller moderne wissenschaftliche Technik, sondern der Fantasie.
Kein Mensch nicht einmal annähernd vorstellen kann Prozesse im Mikrokosmos, so wie Sie ganz ähnlich wie all jene Phänomene, die wir beobachten in den Makrokosmos. Grübeln Sie nur: die neuesten Entdeckungen geben Anlass zu der Annahme, dass die Quarks, Neutrinos und andere fundamentale Teilchen gibt es in девятимерном (!) Dimension. Wie der Mensch lebt im dreidimensionalen Raum, kann sogar ungefähr beschreiben Ihr Verhalten?
Im Moment bleibt uns nur das Vertrauen auf die Mathematik und die macht der modernen Computer, die, sein kann, werden für die Modellierung des Mikrokosmos. Spürbar hilft und Chemie: Struktur des atoms wird sicherlich revidiert, nachdem kürzlich Wissenschaftler arbeiten in diesem Bereich, berichtet über die Eröffnung einer neuen Art der chemischen Bindung.
Die Moderne Vorstellung über die Struktur des atoms
Wenn Sie sorgfältig Lesen Sie alle der oben genannten, dann sicherlich selbst in der Lage zu sagen, was die heutige Vorstellung über die Struktur der Atome Substanzen. Aber wir lassen Sie uns erklären: dies ist eine etwas modifizierte Theorie von Rutherford, ergänzt mit wertvollen überlegungen von Niels Bohr. Einfach ausgedrückt, heute wird angenommen, dass die Elektronen bewegen sich in die chaotischen, verschwommenen Bahnen in der Nähe des Kernes, die besteht aus Neutronen und Protonen. Der Teil der Raum um ihn herum, in dem die Entstehung von Elektron sehr wahrscheinlich, nennt man Orbital.
Noch nicht möglich, genau zu sagen, wie ändern sich unsere Vorstellungen über die Struktur des atoms in der Zukunft. Täglich Wissenschaftler arbeiten an dem eindringen in die Geheimnisse der Mikrowelt: BUCK (Große andronnyj Collider), Nobelpreis im Bereich der Physik – all dies ist das Ergebnis dieser Forschung.
Aber auch jetzt haben wir keine Ahnung und Ungefähre Bild von dem, was noch zu verstecken Atome. Klar ist nur, dass selbst das Atom auf der Skala des Mikrokosmos – ein riesiges Mietshaus, in dem uns untersucht, außer dass die erste Etage, und selbst dann nicht vollständig. Fast jedes Jahr gibt es Berichte über die Möglichkeit der Entdeckung immer neuer Elementarteilchen. Wenn die Untersuchung von Atomen wird komplett fertig, heute nicht prognostizieren niemand nehmen.
 Es Genügt zu sagen, dass unsere Vorstellungen von Ihnen begannen sich zu verändern nur seit 1947, wenn Sie geöffnet waren sogenannte V-Teilchen. Bis zu diesem Menschen nur ein wenig vertieft die Theorien, auf denen vom 19. Jahrhunderts war die Chemie. Struktur des atoms ü spannende Rätsel, lösen von dem die besten Denker der Menschheit beschäftigt.
Es Genügt zu sagen, dass unsere Vorstellungen von Ihnen begannen sich zu verändern nur seit 1947, wenn Sie geöffnet waren sogenannte V-Teilchen. Bis zu diesem Menschen nur ein wenig vertieft die Theorien, auf denen vom 19. Jahrhunderts war die Chemie. Struktur des atoms ü spannende Rätsel, lösen von dem die besten Denker der Menschheit beschäftigt.
Article in other languages:
BE: https://tostpost.com/be/adukacyya/33083-atam-u-h-m---geta-madel-atama-budova-atama.html
KK: https://tostpost.com/kk/b-l-m/33409-atom-himiya---b-l-model-atom-fizikasy-atom-rylysy.html
PL: https://tostpost.com/pl/edukacja/34457-atom-w-chemii---to-model-atomu-budowa-atomu.html
TR: https://tostpost.com/tr/e-itim/29835-atom-kimya-atom-modeli-atomun-yap-s.html
UK: https://tostpost.com/uk/osv-ta/33603-atom-u-h-m---ce-model-atoma-budova-atoma.html

Alin Trodden - autor des Artikels, Herausgeber
"Hi, ich bin Alin Trodden. Ich schreibe Texte, lese Bücher und suche nach Eindrücken. Und ich bin nicht schlecht darin, dir davon zu erzählen. Ich freue mich immer, an interessanten Projekten teilzunehmen."
Verwandte News
seit der Geburt bis zum Tod eine Person hat, ständig zu lernen, um zu überleben, um Anpassung an die volatile Wirklichkeit zu finden und sich selbst zu erkennen und vernünftig zu Leben. Das Konzept der kontinuierlichen Bildung, Au...
Eine einleitende Wendung. Einführende Worte, Wortgruppen und Sätzen. Inszenierung Zeichensetzung
In seiner Rede die Menschen oft benutzen einführende Design, zeigen Sie Ihre Haltung zu dem, wovon Sie erzählen. Beim schreiben der einleitende Wendung hebt sich unbedingt mit Kommas und in der mündlichen Rede eine solche Wendung ...
Auf welchem Fluss steht Kasan. Natürliche Sehenswürdigkeiten in Kasan
Kazan – die Hauptstadt Tatarstans. Die Stadt hat eine tausendjährige Geschichte, die einzigartige Kultur, entwickelten Volkswirtschaften, ist das wissenschaftliche Zentrum der Republik. Auf seinem Gebiet befindet sich ein wi...
Antonyme – dies ist die genannten einander im Sinne, sondern gehören zu den gleichen Wortarten Wörter. Sie haben unterschiedliche Schreibweise und Klang. Bestimmen Sie den Wert eines антонима sehr einfach durch ein anderes, ...
Wer war der erste Erfinder des Radios?
A. S. Popow - Erfinder des Radios, die können stolz auf unser Land. Er ist der erste begann das Studium der elektromagnetischen Wellen, war ein Lehrer und sogar die entsprechenden Kurse für Offiziere. Gerade Pfaffen fand die prakt...
"Medien": lexikalische Bedeutung des Wortes, Synonyme und Interpretation
die Komplexität der Bestimmung der lexikalischen Bedeutung des Wortes „Medien“ darin, dass das Wörterbuch gibt nur die Entschlüsselung der Akronyme. Deshalb umfassenderes Verständnis des Begriffs haben, selbst zu formu...






















Kommentare (0)
Dieser Artikel wurde noch kein Kommentar abgegeben, sei der erste!