Now - 09:36:19
Eigenschaft des Natriums. Formel Natrium
Natrium ä einer der Alkalimetalle. Tabelle der chemischen Elemente zeigt es als Atom, in Bezug auf die Dritte Periode und die erste Gruppe.
Physikalische Eigenschaften
In diesem Abschnitt betrachtet werden, die Eigenschaft von Natrium aus der Sicht der Physik. Beginnen wir mit der Tatsache, dass in reiner Form ist es ein fester Stoff in Silber mit metallischem Glanz und geringer Härte. Natrium ist so weich, dass es mit Leichtigkeit können Sie mit einem Messer schneiden. Der Schmelzpunkt des Stoffes ist ziemlich niedrig und beträgt siebzig neun Grad Celsius. Die Atomare Masse von Natrium ist auch ein kleiner, darüber reden wir später. Die Dichte des Metalls beträgt 0,97 G/cm3.
Chemische Charakterisierung Natrium
Dieses Element hat eine sehr hohe Aktivität ä er ist in der Lage, schnell und heftig reagiert mit vielen anderen Stoffen. Auch die Tabelle der chemischen Elemente ermöglicht solch einer Größe zu bestimmen, wie molare Masse ä für Natrium beträgt dreiundzwanzig. Ein Maulwurf — dies ist die Menge der Substanz, die enthält 6,02 x 10 23 Grad der Atome (Moleküle, wenn der Stoff schwierig). Zu wissen, molare Masse des Elements, können Sie bestimmen, wie viel Wiegen die konkrete Anzahl der Mole dieses вещетсва. Zum Beispiel, zwei mol Natrium wiegt sechsundvierzig Gramm. Wie bereits oben erwähnt, dieses Metall zu ä einer der chemisch aktiven, gehört er zu den alkalischen, beziehungsweise, OXID Lauge bilden kann (starke Basen).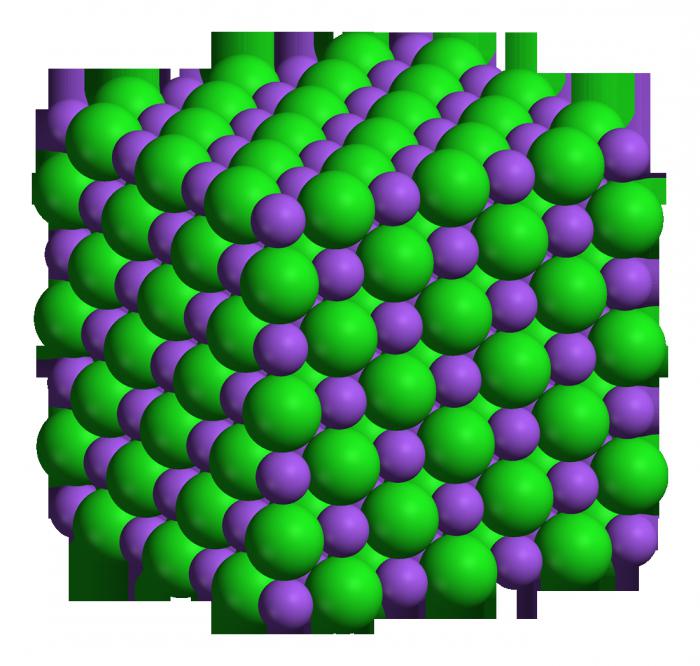
Wie bilden sich die Oxide
Alle Stoffe dieser Gruppe, einschließlich im Fall von Natrium, erhalten durch brennen des ursprünglichen. Somit gibt es eine Reaktion des Metalls mit Sauerstoff, was zur Bildung des Oxids. Zum Beispiel, wenn Sie brennen vier mol Natrium, verbringen ein mol Sauerstoff bekommen und zwei mol OXID dieses Metalls. Formel Natrium-OXID ä Na2O. die Gleichung der Reaktion sieht so aus: 4Na + Über2 = 2Na2O. Wenn man hinzufügt zu der erhaltenen Substanz Wasser bildet sich Lauge ä NaOH.
Mehr:
Das Deutsche Flugzeug "Messerschmitt-262": die Geschichte der Entstehung, Merkmale, Foto
High-Speed-Strahltriebwerk-Kämpfer-Abfangjäger Messerschmitt ME-262 Schwalbe („Messerschmitt ME-262 Schwalbe») erschien auf dem Schlachtfeld nur im Jahr 1944. Man kann nicht genau sagen, für welchen Job diese Maschine bestimmt. Experiment...
Moderne Schule: Geschichte, Voraussetzungen, Probleme. Modelle der modernen Schulen
Historische Entstehung von Schulen förderte den Wunsch der Menschen die Welt zu erkennen und erweitern Ihre Kenntnisse. Deshalb versucht der Mensch zur Gemeinschaft mit den weisen und sehnte sich danach von Ihnen zu lernen wissen.die Geschichte der m...
"Haare zu Berge": Bedeutung, Herkunft фразеологизма
In der Russischen Sprache treffen eine ausreichende Anzahl von geheimnisvollen Floskeln, über deren Bedeutung schwer zu erraten. Die sprachliche Konstruktion „die Haare» gehört eindeutig zu den solchen. Zum Glück, der Ursprung dieses Ausd...
Unter einem mol OXID und Wasser, so erhalten wir zwei mol Basis. Hier ist die Gleichung der Reaktion: Na2O + N2O = 2NaOH. Die resultierende Substanz wird auch als Natriumhydroxid. Dies ist aufgrund seiner starken alkalischen Eigenschaften und eine hohe Chemische активнотью. Wie starke Säuren, Natriumhydroxid aktiv reagiert mit Salzen inaktiven Metallen, organischen verbindungen etc. Während der Interaktion mit Salzen erfolgt die Reaktion Sharing ä entsteht neues Salz und eine neue Grundlage. Lösung von Natrium kann leicht zu zerstören Gewebe, Papier, Haut, Nägel, so dass es erfordert die Einhaltung der Sicherheitsregeln während der Arbeit mit ihm. Gilt Natriumhydroxid in der chemischen Industrie als Katalysator, sondern auch im Alltag als Mittel zur Behebung des Problems verstopften Rohren.
Reaktion mit Halogenen

Es ist eine einfache Substanz, bestehend aus chemischen Elementen, die sich auf der siebten Gruppe des Periodensystems. Diese beinhalten Fluor, Iod, Chlor, Brom. Natrium ist in der Lage zu reagieren, mit allen von Ihnen, bilden solche verbindungen, wie Kaliumchlorid/бромистый/Iodid/ftoristyj das Natrium. Für die Reaktion braucht man zwei mol des betrachteten Metalls, fügen Sie ihn einem mol Fluor. Das Ergebnis ist ftoristyj das Natrium in einer Menge von zwei mol. Dieser Prozess können Sie in Form einer Gleichung: Na + F2 = 2NaF. Фтористий Natrium, die wir erhalten haben, bei der Herstellung von Zahnpasten gegen Karies, sowie Reinigungsmittel für die verschiedenen Oberflächen. Ebenso beim hinzufügen von Chlor erhalten werden kann Natriumchlorid (Kochsalz), Natrium Iodid, welches in der Herstellung von Metall-Halogen-Lampen, бромистый Natrium, angewendet als Arzneimittel bei Nervosität, Schlaflosigkeit, Hysterie und andere nervöse Störungen.
Mit anderen einfachen Stoffen
Auch mögliche Reaktionen des Natriums mit Phosphor, сульфуром (Grau), Kohlefaser (Carbon). Diese Art der chemischen Wechselwirkung kann nur im Falle einer besonderen Bedingungen in Form von hoher Temperatur. Somit erfolgt die Reaktion des Beitritts. Mit Ihrer Hilfe kann man solche Stoffe, wie Natrium-Phosphid, Natrium-Sulfid, Natrium-Karbid.
Als Beispiel kann man den Beitritt der Atome dieses Metalls die Atome des Phosphors. Wenn man drei mol des betrachteten pro mol Metall und der zweiten Komponente, dann erhitzen Sie, dann bekommen wir ein mol Natrium-Phosphid. Diese Reaktion können Sie in Form einer der folgenden Gleichung: 3Na + P = Na3P. außerdem Natrium ist in der Lage, reagieren mit dem Stickstoff, aber auch Wasserstoff. Im ersten Fall bildet sich das Nitrid des Metalls, im zweiten ä Hydrid. Als Beispiele sind solche Gleichungen von chemischen Reaktionen: 6Na + N2 = 2Na3N; 2Na + h2 = 2NaH. Für die Durchführung der ersten Interaktion erfordert eine elektrische Entladung, die zweite ä hohe Temperatur.
Reaktionen mit Säuren
Auf die einfachen Stoffe Chemische Charakterisierung Natrium nicht zu Ende. Dieses Metall kommt auch in der Reaktion mit allen Säuren. Infolge der ähnlichen chemischen Interaktionen entsteht ein Salz von Natrium und Wasserstoff. Zum Beispiel bei der Reaktion des betrachteten Metalls mit Salzsäure bildet sich der Koch-Salz und Wasserstoff,das verdampft. Ausdruck dieser Reaktion kann mit Hilfe der Gleichung der Reaktion: Na + HCl = NaCl + H2. Derartige Chemische Wechselwirkung Substitution-Reaktion genannt. Mit Ihrer Durchführung können auch solche Salze wie Phosphat, Nitrat, Nitrit, Sulfat, Sulfit, Carbonat von Natrium.
Interaktion mit Salzen
Natrium reagiert mit Salzen allen Metallen außer Kalium und Kalzium (Sie haben eine höhere Chemische Aktivität, als das betreffende Element). In einem solchen Fall, wie in der vorherigen, tritt eine Reaktion der Substitution. Die Atome des betrachteten Metalls werden am Ort der Atome mehr chemisch schwach Metall. So mischen Sie zwei mol pro mol Natrium und Magnesium Nitrat, bekommen Nitrat Natrium in einer Menge von zwei mol, sowie reines Magnesium — ein Maulwurf. Notieren Gleichung diese Reaktion kann so: 2Na + Mg(NO3)2 = 2NaNO3 + Mg. Nach dem gleichen Prinzip können Sie und viele andere Natriumsalze. Auch auf diese Weise erhalten Sie Metalle aus Ihren Salzen.
Was passiert, wenn man zu Natrium Wasser
Das Ist wohl einer der häufigsten Stoffe auf dem Planeten. Und mit ihm der fraglichen Metall kann auch in Chemische Wechselwirkung treten. Dabei bildet sich bereits die oben diskutierten Natriumhydroxid oder Natronlauge.
Für die Durchführung einer solchen Reaktion müssen zwei mol Natrium, Wasser hinzufügen, ist auch in der Zahl von zwei mol, und im Ergebnis bekommen wir zwei mol Natriumhydroxid und einem mol Wasserstoff, die sich in Form von Gas mit stechendem Geruch.
Natrium und seine Auswirkungen auf die Organismen
Betrachten Sie dieses Metall aus chemischer Sicht, kommen wir zu dem, was die biologische Eigenschaft des Natriums. Es ist eines der wichtigsten Spurenelemente. Vor allem, er ist einer der Bestandteile tierischer Zellen. Hier erfüllt er eine wichtige Funktion: zusammen mit Kalium unterstützt das membranpotential, beteiligt sich an der Bildung und Verbreitung von Nervenimpulsen zwischen den Zellen, ist eine notwendige chemisches Element für osmotische Prozesse (was brauchen Sie, zum Beispiel, für das funktionieren der Zellen der Nieren). Darüber hinaus Natrium ist verantwortlich für Flüssigkeits-und Elektrolythaushalt der Zelle. Auch ohne dieses Chemische Element ist nicht möglich den Transport durch Blut-Glukose, die so notwendig für das funktionieren des Gehirns. Noch dieses Metall nimmt im Laufe der Muskelkontraktionen.
Dieses Spurenelement ist nicht nur für Tier ä Natrium im Körper der Pflanzen auch erfüllt wichtige Funktionen: er beteiligt sich am Prozess der Photosynthese, hilft transportieren Kohlenhydrate und ist auch wichtig für die Passage von organischen und anorganischen Substanzen durch die Membran.
Überschuss und ein Mangel an Natrium
Zu einem erhöhten Gehalt an bestimmten chemischen Element im Körper kann dazu führen, übermäßiger Konsum von Salz für eine lange Zeit. Anzeichen für einen überschuss an Natrium kann ein Fieber, ödeme, nervöse Reizbarkeit, Störung der Nierenfunktion. Im Falle solcher Symptome muss man Kochsalz aus der Ernährung und die Lebensmittel, in denen viel dieses Metalls (die Liste finden Sie unten), danach sofort Arzt konsultieren. Ein verringerter Gehalt im Körper von Natrium führt auch zu unangenehmen Symptomen und Verletzungen der Organe. Ausgewaschen dieses Chemische Element kann bei längerer Einnahme von Diuretika oder beim Gebrauch im trinken nur gereinigtes (destilliertes) Wasser, bei erhöhtem Schwitzen und Dehydrierung. Anzeichen von Mangel an Natrium sind Durst, Trockenheit der Haut und Schleimhäute, Erbrechen und übelkeit, Appetitlosigkeit, Verletzung des Bewusstseins und der Apathie, Tachykardie, Beendigung der vollen Arbeit der Nieren.
Produkte, in denen viel Natrium
Um zu vermeiden, einen zu hohen oder zu niedrigen Gehalt im Körper des betrachteten chemischen Elements, müssen Sie wissen, in welchem Essen ihn am meisten. Vor allem, das ist der oben erwähnte Koch-Salz. Sie ist auf vierzig Prozent aus Natrium. Es kann auch Meersalz sein. Darüber hinaus ist dieses Metall enthalten in Sojabohnen und Sojasauce. Eine große Menge an Natrium tritt in den Meeresfrüchten. Diese Algen, die meisten Arten von Fischen, Garnelen, Tintenfisch, Krabbenfleisch, Kaviar, Krebse, etc. Natriumgehalt in Ihnen verbunden mit der Tatsache, dass diese Organismen Leben in salzigen Umgebungen mit einer hohen Konzentration von Salzen verschiedener Metalle, die wichtig für das reibungslose funktionieren des Körpers.
Die Verwendung dieses Metalls und einige seiner verbindungen
Die Anwendung von Natrium in der Industrie sehr vielseitig. Vor allem, diese Substanz verwendet in der chemischen Industrie. Hier ist es notwendig, um solche Substanzen, wie Hydroxid des betrachteten Metalls, Fluoride, Sulfate und Nitrate. Außerdem wird es verwendet als starke Reduktionsmittel — für die Zuteilung der reinen Metalle aus Ihren Salzen. Es gibt ein spezielles technisches Natrium, das speziell für die Verwendung für derartige Zwecke. Seine Eigenschaften werden im Gast 3273-75. Im Zusammenhang mit den oben genannten stark reduzierenden Eigenschaften Natrium ist weit verbreitet in der Metallurgie.
Auch dieses Chemische Element findet seinen Einsatz in фамацевтической Branche, wo er am häufigsten benötigt, um seine Bromid, das eines der wichtigsten Komponentenvielen Sedativa und Antidepressiva. Darüber hinaus, Natrium kann in der Herstellung von HID-Lampen ä solche Quellen werden von hellen gelben Licht. Ist eine Chemische Verbindung, wie Natrium Chlorat (NaClO3), tötet die Jungen Pflanzen, deshalb es verwenden für die Entfernung von solchen mit Gleisanlagen für die Warnung Wucherung des letzteren. Natriumcyanid erhielt eine Breite Anwendung in der Industrie zur Gewinnung von Gold. Mit seiner Hilfe erhalten dieses Metall aus dem gestein.
Wie bekommt man das Natrium
Die gängigste Methode ist die Reaktion des Karbonats des betrachteten Metalls mit Kohlenstoff. Dazu müssen Sie heizen die beiden genannten Substanzen auf eine Temperatur von etwa tausend Grad Celsius. In der Folge bilden sich zwei solche chemischen verbindungen, wie Natrium und чадный Gas. Bei der Wechselwirkung von einem mol Natriumcarbonat mit zwei mol Karbon bekommen zwei mol des gewünschten Metalls und drei mol Kohlendioxid. Die Gleichung der Reaktion kann wie folgt geschrieben: NaCO3 + 2S = 2Na + 3СО. In ähnlicher Weise dieses Chemische Element erhalten werden kann und aus anderen verbindungen.
Hochwertige Reaktionen
Das Vorhandensein von Natrium+, als auch alle anderen Kationen oder Anionen, können identifiziert werden, durch die Durchführung von speziellen chemischen Manipulationen. Qualitative Reaktion auf Natrium-Ion ist das verbrennen " im Falle der Anwesenheit seiner Flamme wird gefärbt in der Farbe gelb.
Wo man das betreffende Chemische Element in der Natur
Erstens, wie schon gesagt, es ist einer der Bestandteile wie Tierische und pflanzliche Zellen. Auch seine hohe Konzentration im Meerwasser beobachtet. Darüber hinaus, Natrium tritt in der Zusammensetzung einiger Mineralien. Dies ist zum Beispiel, сильвинит, seine Formel ä NaCl • KCl, sowie карналлит, dessen Formel KCl•MgCl2•6H2O. die Erste von Ihnen besitzt eine inhomogene Struktur mit wechselnder bunten Teile, in seiner Färbung auftreten orange, rosa, blau, rot. Dieses Mineral vollständig löslich in Wasser. Карналлит, je nach Ort der Bildung und Verunreinigungen, kann auch eine unterschiedliche Färbung. Es kann in rot, gelb, weiß, hell-blau, sowie transparent. Er hat einen schwachen Glanz, Lichtstrahlen in ihm stark gebrochen. Diese beiden Mineralstoffe dienen als Rohstoff für die Gewinnung von Metallen, die in Ihrer Zusammensetzung: Natrium, Kalium, Magnesium.
Wissenschaftler glauben, dass das Metall, die wir prüften in diesem Artikel ist einer der häufigsten in der Natur, da der Massenanteil der ihn in der Erdkruste beträgt zweieinhalb Prozent.
Article in other languages:
AR: https://tostpost.com/ar/education/15467-characteristics-of-sodium-the-formula-of-sodium.html
BE: https://tostpost.com/be/adukacyya/26684-haraktarystyka-natryyu-formula-natryyu.html
En: https://tostpost.com/education/26040-characteristics-of-sodium-the-formula-of-sodium.html
ES: https://tostpost.com/es/la-educaci-n/26240-caracter-stica-de-sodio-la-f-rmula-de-sodio.html
HI: https://tostpost.com/hi/education/15186-characteristics-of-sodium-the-formula-of-sodium.html
JA: https://tostpost.com/ja/education/15135-characteristics-of-sodium-the-formula-of-sodium.html
KK: https://tostpost.com/kk/b-l-m/26984-sipattamasy-natriy-formulasy-natriy.html
PL: https://tostpost.com/pl/edukacja/28052-charakterystyka-sodu-formu-a-sodu.html
PT: https://tostpost.com/pt/educa-o/27800-a-caracter-stica-de-s-dio-a-f-rmula-de-s-dio.html
TR: https://tostpost.com/tr/e-itim/26898-zelli-i-sodyum-form-l-sodyum.html
UK: https://tostpost.com/uk/osv-ta/27255-harakteristika-natr-yu-formula-natr-yu.html
ZH: https://tostpost.com/zh/education/10139-characteristics-of-sodium-the-formula-of-sodium.html

Alin Trodden - autor des Artikels, Herausgeber
"Hi, ich bin Alin Trodden. Ich schreibe Texte, lese Bücher und suche nach Eindrücken. Und ich bin nicht schlecht darin, dir davon zu erzählen. Ich freue mich immer, an interessanten Projekten teilzunehmen."
Verwandte News
Eigenschaft des Natriums. Formel Natrium
Natrium ä einer der Alkalimetalle. Tabelle der chemischen Elemente zeigt es als Atom, in Bezug auf die Dritte Periode und die erste Gruppe.Physikalische EigenschaftenIn diesem Abschnitt betrachtet werden, die Eigenschaft von ...
Logische Aufgaben für Kinder 6-7 Jahre mit Antworten
Logische Aufgaben für Kinder von 6-7 Jahren helfen, die richtige Denkweise zu entwickeln, zu gestalten Interesse an der mathematischen Bildung der Kinder im Vorschulalter.Altersbedingte MerkmaleGerade in der jüngeren vorschulische...
Glühbirne Edison. Wer erfand die erste Glühbirne? Warum alle Ehre zugefallen Edison?
Gewöhnliche Glühbirne, die fast in jedem Haus, oft als Glühbirne Edison. Die Geschichte seiner Erfindung war nicht so einfach. Bevor Sie Spenden das künstliche Licht von Milliarden von Menschen, es ging ein langer Weg der Entwickl...
Milcheiweiß und Hydrolyse von Proteinen
Protein – dies ist eine Chemikalie, die eine organische hochmolekulare Verbindung des Typs. In der Zusammensetzung der Protein gibt es mehr als hundert Reste der verschiedenen Aminosäuren. Jeder Mensch in seinem Organi...
Klassifizierung Der Naturwissenschaften
das Problem der Klassifizierung der Wissenschaften liegt in der Komplexität der Ansätze zur Trennung der wissenschaftlichen Disziplinen auf die einzelnen Klassen. Die Aufgabe der Bildung des kompletten Systems erfordert die Erfass...
Chlorwasserstoff ist ein Gas, etwa 1,3-mal schwerer als Luft. Er ist ohne Farbe, aber mit einem scharfen Würgen und charakteristischen Geruch. Bei einer Temperatur von minus 84С Chlorwasserstoff geht vom gasförmigen in den flüssig...























Kommentare (0)
Dieser Artikel wurde noch kein Kommentar abgegeben, sei der erste!