Now - 14:41:31
Característica de sodio. La fórmula de sodio
El Sodio á s uno de los metales alcalinos. La tabla de elementos químicos, se muestra como un átomo, correspondiente al tercer período y al primer grupo.
Las propiedades Físicas
En esta sección se verá en el reportaje de sodio desde el punto de vista de la física. Comencemos con el hecho de que en su forma pura es un sólido de color plateado, posee brillo metálico y de baja dureza. El sodio es tan suave, que con facilidad se puede cortar con un cuchillo. La temperatura de fusión de una sustancia es muy bajo y es de setenta y nueve grados centígrados. Masa atómica del sodio también es pequeña, de ella hablaremos más adelante. La densidad de este metal es igual a 0,97 g/cm3.
Descripción Química de sodio
Este elemento tiene una muy alta actividad á s es capaz de rápidamente y reaccionar con muchas otras sustancias. También la tabla de elementos químicos permite determinar tal magnitud, como la masa molar á s de sodio es de veinte y tres. Un mol á s es la cantidad de sustancia que contiene 6,02 x 10 23 grado de átomos (moléculas, si la sustancia compleja). Sabiendo молярную la masa de un elemento, se puede determinar cuánto pesará una cantidad específica de la polilla de este вещетсва. Por ejemplo, dos de mol de sodio pesa cuarenta y seis gramos. Como ya se mencionó anteriormente, este metal á s uno de los más activos químicamente, que se refiere a alcalino, por tanto, el óxido puede formar un álcali (fuertes razones).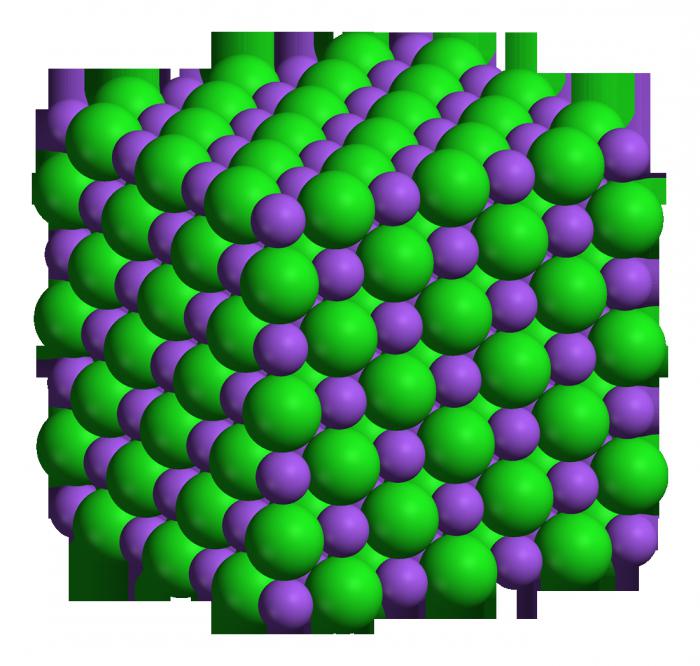
Cómo se forman los óxidos de
Todas las sustancias de este grupo, incluso en el caso de que con el sodio, se puede obtener a través de la quema de origen. Por lo tanto, se produce una reacción de un metal con el oxígeno, lo que provoca la formación de óxido. Por ejemplo, si se quema cuatro mol de sodio, gastaremos un mol de oxígeno, y obtendremos dos mol de óxido del metal. La fórmula de sodio óxido de á s Na2O. la Ecuación de la reacción es: 4na es un + O2 = 2Na2O. Si añadir a la sustancia de que se trate el agua, se forma el c á s NaOH.
Más:
El general walter von Reichenau: su biografía, sus logros y la historia
El General mariscal de campo de la alemania nazi walter von Reichenau (Walter von Reichenau) se contaba entre los pocos altos oficiales del ejército de la wehrmacht, que apoyó activamente el nazismo. Durante la Segunda guerra mundial fue comandante d...
Trajes espaciales de los astronautas: de la asignación de la unidad. El primer traje espacial
Trajes espaciales de los astronautas – no es simplemente trajes de vuelo en órbita. El primero de ellos se remonta a principios del siglo veinte. Era la época de antes de los vuelos espaciales restaba casi medio siglo. Sin embargo, los científi...
Oriental de la plataforma europea: forma de alivio. Minerales oriental de la plataforma europea
La Mayor parte del territorio europeo de rusia, así como de algunos países de la cei se encuentra en la parte continental de un tramo de la corteza terrestre, que lleva el nombre oriental de la plataforma europea. La forma del relieve aquí es predomi...
Tomó un mol de óxido y agua, recibiremos dos polilla de la base. He aquí la ecuación de esta reacción: Na2O + H2 = 2NaOH. Recibida esta sustancia se llama hidróxido de sodio. Esto se debe a su notable las propiedades alcalinas y de alta química активнотью. Como ácidos fuertes, hidróxido de sodio activamente reacciona con las sales малоактивных de metales, compuestos orgánicos, etc. En el momento de la interacción con las sales se produce una reacción de intercambio de á s se forma un nuevo sol y una nueva infraestructura. La solución de sodio cáustica puede fácilmente destruir la tela, el papel, la piel, las uñas, por lo tanto, se requiere el cumplimiento de las normas de seguridad durante el trabajo con él. Se aplica el hidróxido de sodio en la industria química como catalizador, así como en la vida cotidiana como herramienta para la solución de problemas sembrados de tubos.
La Reacción con halógenos

Se Trata de simples sustancias, compuestos de elementos químicos, que se refieren a la séptima grupo de la tabla periódica. En su lista incluye flúor, yodo, cloro, bromo. El sodio es capaz de reaccionar con todos ellos, formando compuestos como el cloruro de/bromuro de/yoduro/fluoruro de sodio. Para la realización de la reacción es necesario tomar dos polilla del metal, agregarle un mol de flúor. Como resultado obtenemos el fluoruro de sodio en el número dos de la mole. Este proceso se puede escribir como la ecuación: Na + F2 = 2NaF. Фтористий de sodio, que hemos recibido, se emplea en la fabricación de cremas dentales contra la caries y detergentes para una gran variedad de superficies. De forma similar, cuando se agrega cloro puede obtener cloruro de sodio (sal de la cocina), yoduro de sodio, que se utiliza en la fabricación de металлогалогенных lámparas, bromuro de sodio, utilizado como un medicamento cuando el nerviosismo, el insomnio, histeria y otros trastornos del sistema nervioso.
Con otras sustancias simples
También puede haber una reacción del sodio con el fósforo, сульфуром (gris), карбоном (de carbono). Este tipo de interacciones químicas se puede realizar sólo en el caso de la creación de condiciones especiales en el formulario de alta temperatura. Por lo tanto, se produce una reacción de la adhesión. Con su ayuda se puede obtener sustancias como el fosfuro de sodio, sodio, sulfuro, el carburo de sodio.
En el ejemplo, la adhesión de los átomos del metal átomos de fósforo. Si toma tres polilla del metal y un mol de la segunda componente y, a continuación, calentar, recibiremos un mol de fosfuro de sodio. Esta reacción se puede escribir como la ecuación siguiente: 3Na + P = Na3P. Además, el sodio es capaz de reaccionar con el nitrógeno y el hidrógeno. En el primer caso, se forma el nitruro de este metal, en el segundo á s гидрид. Como ejemplos de estas ecuaciones de las reacciones químicas: 6Na + N2 = 2Na3N; 2Na + h2 = 2NaH. Para la realización de la primera interacción es necesaria la descarga eléctrica, el segundo á s alta temperatura.
La Reacción con ácidos
En simples sustancias caracterización química de sodio no termina. Este metal también reacciona con todos los ácidos. Como resultado de estas interacciones químicas se forma la sal de sodio e hidrógeno. Por ejemplo, en la reacción del metal con ácido clorhídrico se forma una sal y el hidrógeno,que se evapora. Expresar esta reacción utilizando la ecuación de la reacción: Na + HCl = NaCl + H2. Este tipo de interacción química se denomina reacción de sustitución. Con la ayuda de su celebración, también se puede obtener este tipo de sal, como el fosfato, nitrato, nitrito, sulfato, sulfito, el carbonato de sodio.
La Interacción con las sales
El Sodio reacciona con las sales de los metales, además de potasio y de calcio (que tiene una mayor actividad química, que ese elemento). En este caso, como en el anterior, se produce una reacción de sustitución. Los átomos del metal se convierten en el lugar de los átomos químicamente más débil de metal. Por lo tanto, mezclar dos mol de sodio y un mol de nitrato de magnesio, obtenemos el nitrato de sodio en el número dos de la mole, limpio magnesio á s de una polilla. Escribir una ecuación de esta reacción: 2Na + Mg(NO3)2 = 2NaNO3 + Mg. De la misma forma que se puede obtener y muchas otras sales de sodio. También de esta manera se puede obtener metales a partir de sus sales.
Que va, si a al sodio, a condición de agua
Este Es, quizás, uno de las sustancias más comunes en el planeta. Y con él la cuestión objeto de metal también es capaz de entrar en una interacción química. Se forma ya había sido examinado por encima de hidróxido de sodio o hidróxido de sodio.
Para realizar esta reacción necesita tomar dos mol de sodio, agregar al agua, también en el número dos de la polilla, y como resultado obtendremos dos mol de hidrógeno y un mol de hidrógeno, que se selecciona en forma de gas con un olor fuerte.
De Sodio y de sus efectos en el organismo
Habiendo Examinado este metal con un punto de vista químico, pasemos a lo qué biológica característica de sodio. Es uno de los micronutrientes. Ante todo, él es uno de los componentes de la célula animal. Aquí se cumple funciones importantes: junto con el potasio mantiene el potencial de membrana de la que participa en la educación y la difusión entre las células del impulso nervioso, es un elemento químico de осмотических de los procesos (lo que se necesita, por ejemplo, para el funcionamiento de las células de los riñones). Además, el sodio es el responsable de los humedales de solución salina equilibrio de la célula. Sin este elemento químico no es posible el transporte de la glucosa en la sangre, tan necesaria para el funcionamiento del cerebro. Este metal, participa en el proceso de reducción de la мыщц.
Este oligoelemento es necesario no sólo los animales á s de sodio en el cuerpo de las plantas también cumple funciones importantes: participa en el proceso de la fotosíntesis, ayudando a transportar los hidratos de carbono, y también es necesario para el paso de sustancias orgánicas e inorgánicas a través de una membrana.
El Exceso y la falta de sodio
A un mayor contenido de este elemento químico en el cuerpo puede causar el consumo excesivo de sal a lo largo de mucho tiempo. Los síntomas del exceso de sodio puede ser el aumento de la temperatura corporal, la hinchazón, aumento de la excitabilidad del sistema nervioso central, el mal funcionamiento de los riñones. En el caso de la aparición de estos síntomas es necesario eliminar de la dieta de la cocina de sal y productos, en el que muchos de este metal (la lista se muestra a continuación), después consultar a un médico inmediatamente. El contenido bajado en el cuerpo de sodio también provoca desagradables síntomas y fallos de funcionamiento de los órganos. Ser arrastrados por este elemento químico puede prolongada se toman diuréticos o al uso de la bebida sólo purificada (agua destilada) de agua, en caso de incrementarse el потоотделении y deshidratación del organismo. Los síntomas de la falta de sodio son la sed, sequedad de la piel y de las membranas mucosas, vómitos y náuseas, falta de apetito, alteración de la conciencia y la fatiga, taquicardia, la terminación satisfactoria del trabajo de los riñones.
Productos, en el que muchos de sodio
Para evitar demasiado alto o demasiado bajo contenido en el cuerpo del elemento químico, debe saber en qué alimentos lo más posible. Ante todo, es la ya mencionada de cocina a la sal. Ella en un cuarenta por ciento de sodio. También puede ser la sal del mar. Además, este metal se contiene en la soja y salsa de soja. Una gran cantidad de sodio se observa en pescados y mariscos. Es la berza marina, la mayoría de especies de peces, camarones, pulpo, cangrejo trozos de carne, caviar, cangrejos y otros, el Contenido de sodio en ellos se debe a que los datos de los organismos que habitan en un medio salino con alta concentración de sales de metales diferentes, importantes para el funcionamiento normal del organismo.
El Uso de este metal y algunos de sus compuestos
La Aplicación de sodio en la industria es muy versátil. En primer lugar, la sustancia utilizan en la industria química. Aquí se requiere para la obtención de sustancias como el hidróxido del metal, fluoruros, sulfatos y nitratos. Además, se utiliza como un poderoso agente reductor á s para resaltar el limpiador de metales a partir de sus sales. Existe una técnica específica de sodio, diseñado para su uso en tales propósitos. Sus propiedades confirmado en el Trabajo 3273-75. A raíz de los mencionados fuertes restauración de las propiedades de sodio es ampliamente utilizado en metalurgia.
Además, este elemento químico encuentra su uso en фамацевтической de la industria, donde es más frecuente es necesaria para obtener su bromuro, que es uno de los principales componentes demuchos de sedantes y antidepresivos. Además, el sodio puede ser utilizado en la fabricación de las lámparas hid á s los orígenes de amarillo brillante de la luz. Qué es un compuesto químico, como el clorato de sodio (NaClO3), destruye las plantas jóvenes, por lo que se utiliza para la eliminación de tales, con las vías del ferrocarril para la prevención de la зарастания últimos. El cianuro de sodio tienen un amplio uso en la industria de extracción de oro. Con su ayuda, reciben el metal de la roca.
¿Como se obtiene el sodio
La forma Más común es la reacción del carbonato de metal con el carbono. Para ello, se debe calentar los dos de una sustancia a una temperatura de alrededor de mil grados centígrados. Como resultado de ello, se forman dos compuestos químicos como el sodio y чадный gas. En la interacción de un mol de carbonato de sodio con dos mol de carbono tendrá dos polilla deseado de metal y tres mol de óxido de carbono. La ecuación de la reacción se puede escribir de la siguiente manera: NaCO3 + 2C = 2Na + 3СО. De esa manera este elemento químico puede obtenerse de otras de sus conexiones.
La Calidad de la reacción de
La Presencia de sodio+, así como con los demás cationes o aniones, se puede determinar mediante la realización de especialidades químicas de la manipulación. Calidad de la reacción del ion sodio es la quema de á s en el caso de la presencia de su llama aparecerá en un color amarillo.
Donde se puede encontrar a la cuestión objeto de un elemento químico en la naturaleza
En primer lugar, como ya se ha dicho, es uno de los componentes de tanto animal como vegetal de la célula. También la alta su concentración se observa en el agua de mar. Además, el sodio entra en la composición de algunos minerales. Esto, por ejemplo, сильвинит, su fórmula á s de NaCl • KCl, así como карналлит, cuya fórmula KCl•MgCl2•6H2O. el Primero de ellos tiene heterogéneo de la estructura de bandas de colores de las piezas, en su coloración, pueden aparecer de color naranja, rosa, azul, rojo. Este mineral es totalmente soluble en agua. Карналлит, dependiendo del lugar de la educación y de las impurezas, también puede tener diferente color. Puede ser de color rojo, amarillo, blanco, gris claro, azul y transparente. Él tiene un tenue brillo, los rayos de luz en él fuertemente se refractan. Estos dos minerales sirven de materia prima para la obtención de los metales que entran en su composición: sodio, potasio, magnesio.
Los Científicos creen que el metal, que hemos examinado en este artículo, es uno de los más comunes en la naturaleza, así como la fracción de la masa en la corteza terrestre es de dos y medio por ciento.
Article in other languages:
AR: https://tostpost.com/ar/education/15467-characteristics-of-sodium-the-formula-of-sodium.html
BE: https://tostpost.com/be/adukacyya/26684-haraktarystyka-natryyu-formula-natryyu.html
DE: https://tostpost.com/de/bildung/26353-eigenschaft-des-natriums-formel-natrium.html
En: https://tostpost.com/education/26040-characteristics-of-sodium-the-formula-of-sodium.html
HI: https://tostpost.com/hi/education/15186-characteristics-of-sodium-the-formula-of-sodium.html
JA: https://tostpost.com/ja/education/15135-characteristics-of-sodium-the-formula-of-sodium.html
KK: https://tostpost.com/kk/b-l-m/26984-sipattamasy-natriy-formulasy-natriy.html
PL: https://tostpost.com/pl/edukacja/28052-charakterystyka-sodu-formu-a-sodu.html
PT: https://tostpost.com/pt/educa-o/27800-a-caracter-stica-de-s-dio-a-f-rmula-de-s-dio.html
TR: https://tostpost.com/tr/e-itim/26898-zelli-i-sodyum-form-l-sodyum.html
UK: https://tostpost.com/uk/osv-ta/27255-harakteristika-natr-yu-formula-natr-yu.html
ZH: https://tostpost.com/zh/education/10139-characteristics-of-sodium-the-formula-of-sodium.html

Alin Trodden - autor del artículo, editor
"Hola, soy Alin Trodden. Escribo textos, leo libros y busco impresiones. Y no soy mala para decírtelo. Siempre estoy feliz de participar en proyectos interesantes."
Noticias Relacionadas Con La
Característica de sodio. La fórmula de sodio
el Sodio á s uno de los metales alcalinos. La tabla de elementos químicos, se muestra como un átomo, correspondiente al tercer período y al primer grupo.las propiedades FísicasEn esta sección se verá en el reportaje de sodi...
el Cloruro de hidrógeno es un gas, aproximadamente 1,3 veces más pesado que el aire. Él, sin color, pero con la explosión de la удушливым y olor característico. Si la temperatura es de menos 84С cloruro de hidrógeno pasa de estado...
En Italiano unido en la década de 1850 los círculos dominantes de la zona de piamonte, hicieron todo lo posible para evitar la convocatoria general italiana de la asamblea Constituyente. Por lo tanto, ellos estaban en contra...
Lógica de tareas para niños de 6 a 7 años, con las respuestas
la Lógica de tareas para niños de 6 a 7 años ayudan a desarrollar la mentalidad correcta, generar interés en la matemática de la educación de los niños preescolares.Edad característicasEs en el la edad preescolar establecieron un ...
Ordinario bombilla, que se utiliza en casi todas las casas, a menudo referida como la bombilla de edison. La historia de su invención no fue tan fácil. Antes de dar luz artificial miles de millones de personas, se ha recorrido un ...
Ordinario bombilla, que se utiliza en casi todas las casas, a menudo referida como la bombilla de edison. La historia de su invención no fue tan fácil. Antes de dar luz artificial miles de millones de personas, se ha recorrido un ...























Comentarios (0)
Este artículo no tiene comentarios, se el primero!