Мышьяковая ácido: propriedades químicas, a fórmula. Высокоопасные substâncias
O Impacto de diferentes substâncias químicas no corpo humano é ambígua. A maioria de nós conhecidos compostos ou são neutros, ou de desempenhar um papel positivo na vida de uma pessoa. Mas há um grupo de substâncias, o que representa uma séria ameaça para a saúde. Eles são divididos em várias classes. Considerado este artigo мышьяковая ácido – um desses tóxicos de compostos químicos. De acordo com o adotado atualmente, a classificação, que vem em segundo grau de perigo, juntamente com хлороформом, compostos de chumbo e lítio. Estudaremos as propriedades мышьяковой ácido mais detalhes.
A Estrutura da molécula e agregada do estado da matéria
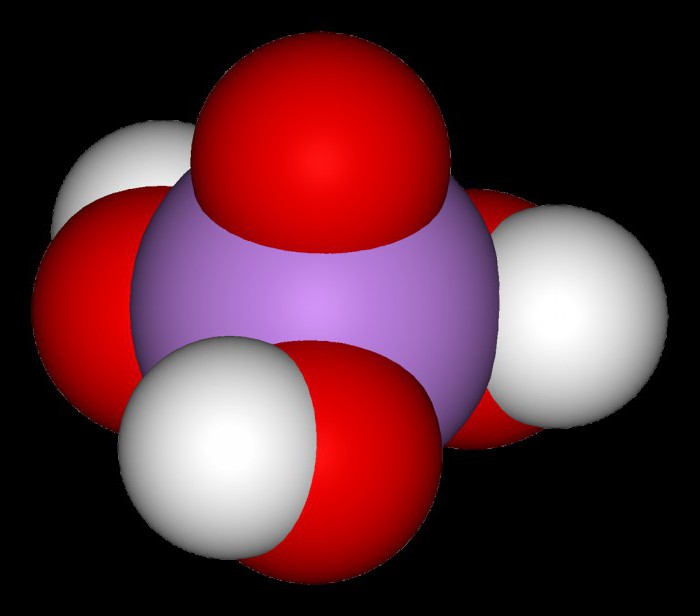
Esta É uma ligação normais, tem uma estrutura cristalina. Como трехосновной, мышьяковая ácido, a fórmula que H3AsO4, tem como médio, e azedo sal. Por exemplo, гидроарсенат de potássio – K2HAsO4, дигидроарсенат de sódio – NaH2AsO4, арсенат de lítio – Li3AsO4. Прокаливая мышьяковую ácido, recebem гемипентоксид arsênico, chamado мышьяковым ангидридом. Sua transparentes brancos os cristais não existe qualquer massa, mal растворяющуюся na água.
Dissociação
H3AsO4, juntamente com o ácido fórmico e гидроксидом de chumbo, é moderadamente fraco de eletrólito. Assim, na tabela de ionização mais importantes ácidos ортомышьяковая ácido tem três constantes de dissociação: 5,6 x 10-3, 1,5 x 10-7 e 3, 89 x 10-12. Esses indicadores quantificados caracterizam a força do ácido. De acordo com constantes de dissociação, em uma série de ácidos inorgânicos H3AsO4 ocupa uma posição entre o cromo e сурьмяной ácidos. Russos químicos-pesquisadores А. Л. e И. Л. Агафоновы formularam uma expressão matemática, em que tiraram a dependência da primeira e da segunda constante de dissociação мышьяковой ácido da temperatura no intervalo entre 0°Com até 50°С.
Mais:
A história do desenvolvimento da tecnologia de computação
Os primeiros dispositivos de computação foram os próprios dedos de uma pessoa. Quando a ferramenta foi suficiente, no curso de iam pedras, galhos, conchas. Dobrando-se de um conjunto de dezenas, depois centenas, o homem aprendeu a contar e usar as fe...
O impulso nervoso, a sua conversão e o mecanismo de transmissão
O sistema Nervoso humano atua como uma espécie de coordenador no nosso corpo. Ela passa o comando do cérebro musculatura, órgãos, tecidos e processa os sinais de longo alcance deles. Como uma espécie de suporte de dados, é usado o impulso nervoso. O ...
Canal do panamá: um ano, a abertura oficial do objecto e a sua importância histórica
Durante séculos, a humanidade tenta recriar condições naturais da Terra, com o objetivo de receber quaisquer benefícios. Um desses casos, a adaptação é do canal do Panamá, o ano, a abertura oficial deste objeto foi marcado por um evento, повлиявшим p...
Características das propriedades químicas
O estado de oxidação do átomo de arsênio, que faz parte da molécula do ácido, é igual a +5. Isso diz sobre o fato de que a própria conexão em reacções químicas com outras substâncias manifesta propriedades oxidantes. Assim, quando a sua interacção com a иодидом de potássio, agindo como um agente de redução, em um ambiente ácido entre os produtos de uma reação de encontrarmos мышьяковистую ácido H3AsO3. Lembre-se que мышьяковая ácido, a fórmula que H3AsO4, é трехосновной, e, portanto, nas reações com álcalis ou нерастворимыми bases ela pode dar três tipos de sal: média, hidro e дигидроарсенаты. A qualidade de uma reação íon AsO43- em química analítica serve a interação mais мышьяковой ácidos ou sais solúveis com sais de prata, por exemplo, com o nitrato. Como resultado observamos precipitação Ag3AsO4 Cor de café.
Йодометрический método de determinação de мышьяковой ácido
Em química analítica, uma tarefa importante é a detecção de compostos químicos em seus respectivos soluções. Мышьяковая ácido, propriedades químicas que vimos anteriormente, pode ser identificado микрометодом йодометрии. A 1 ml de sua solução приливают a mesma quantidade de 4h. uma solução de ácido clorídrico e 1 ml de 4% de solução de iodeto de potássio. Formado сесквиоксид arsênico Como o2O3, Massa em conformidade com os quantitativos quantidades de reagentes é sempre a mesma e igual a 0,5746 мг.

Окислительная capacidade de мышьяковой ácido
Como é sabido, H3AsO4, Como o ácido fosfórico, é o eletrólito de força média. Sua transparentes brancas de cristais de расплываются no ar e têm composição 2H3AsO4 X H2O. sais, formado por metais alcalinos (como médio, e ácidas), em soluções aquosas têm um ph maior do que 7. Арсенаты de lítio, potássio, de sódio e de amônio são bem solúveis em água, e os restantes médios de sal que não se dissolvem. Мышьяковая ácido – um bom agente oxidante. Em redox respostas ela se recupera até мышьяковистой ácido ou арсина.
H3AsO4 + 2e - + 2H+ = H3AsO3 + H2O
H3AsO4 + 8e + 8H+ = AsH3 + 4H2O
Além disso, мышьяковая ácido fácil de oxidar os metais diferentes, сульфитную e йодидную ácido, bem como o sulfeto de hidrogênio.

Obter мышьяковой ácido
Em um ambiente de laboratório de H3AsO4 Pode ser obtido a resposta de сесквиоксида arsênico com нитратной ácido quando aquecido. Nos produtos detectado óxido de nitrogênio trivalente e H3AsO4. Outra forma de obter o – é a dissolução em água de óxido de arsênico. Muitas vezes, para obter informações aplicam simultânea a oxidação e a hidrólise триалкиларсенитов pré-aquecido até 50° Com uma solução de peróxido de hidrogênio. Ao mesmo tempo a partir de reação de uma mistura drenam a água e o álcool. Em seguida, a solução упаривают e recebem мышьяковую ácido de pureza. Na natureza a matéria-prima para a obtenção de мышьяковой ácido servem de minerais: арсенолит e арсенопирит, залежами que são ricos em região de chelyabinsk e Читинская área Da Federação.
Aplicação H3AsO4
Considerando o fato de que ортомышьяковая ácido é um dos pontos fortes venenos. Sua aplicação na indústria e na vida cotidiana é limitado. Mais comum do sal ã арсенаты, cuja toxicidade significativamente menos do quemais H3AsO4. Assim, na indústria da madeira, juntamente com сернокислым zinco e sódio sal пентахлорфенола, мышьяковую o ácido utilizado para o tratamento de madeira. Este método minimiza a perda da destruição de celulose infecções fúngicas e larvas de insetos древоточцев. Na medicina H3AsO4 é usado na composição do medicamento ão Атоксил" para tratamento de протозойных infecções, como a giardíase, балантидиаз, изоспороз.

Deve-se notar que a infestação da população estas infecções recentemente, aumentou dramaticamente. Há várias razões – por exemplo, a infecção através de alimentos que contêm os esporos mais simples, através de picadas de insetos ou doenças sexualmente transmissíveis. Мышьяковая ácido é usada como fonte de substâncias em processos de produção de óptica de vidro, e também em engenharia elétrica. Derivada de H3AsO4 - seu натриевую sal, tem sido utilizado com sucesso em dermatologia e фтизиатрии. Conexão de arsênico utilizados em odontologia (мышьяковая massas) como um medicamento usado para reduzir o ponto de sensibilidade воспаленного do nervo remoção da placa do canal.
A Ação de ácidos no corpo humano
Como já foi dito anteriormente, H3AsO4 Vem em segundo grau de perigo – altamente substâncias perigosas. Mortal é considerado dosagem, como o ácido, e seus sais dentro de 15 a 150 mg por quilograma de peso corporal de uma pessoa. Juntamente com o geral отравляющим efeito, мышьяковая ácido provoca necrose de pele do tegumento e mucosas internas de órgãos: pulmão, estômago, intestinos.
No laboratório durante a realização de experiências com арсенатами e H3AsO4 é obrigatório o uso de luvas de proteção, e os experimentos passam sob o capuz. Em caso de intoxicação no nível de células perturbado a sua ферментативная sistema, assim como ocorre a inativação das enzimas. No corpo humano o envenenamento арсенатами leva a парезам e até mesmo параличам. Na oncologia, quando a realização de quimioterapia ao incumprimento do regime de dosagem de medicamentos são registrados casos de intoxicação миарсенолом e новарсенолом. A primeira assistência ao envenenamento de sais мышьяковой ácido é imediata lavagem gástrica (por exemplo, com solução de унитиола ou drogas de dióxido de silício).

Para evitar a falha renal aguda, prescrito o procedimento de hemodiálise. Como antídoto, além de 5% de solução de унитиола, você pode usar o antídoto Стрижевского. Antes da chegada de emergência ambulância em casa para reduzir o nível de intoxicação pode aplicar solução de ácido cítrico, em seguida, induzir o vômito e lavar o estômago. Todos os terapêuticas atividades devem realizar-se com o cumprimento rigoroso de modo sob a supervisão de um médico.
Article in other languages:

Alin Trodden - autor do artigo, editor
"Olá, sou o Alin Trodden. Escrevo textos, leio livros e procuro impressões. E eu não sou ruim em falar sobre isso. Estou sempre feliz em participar de projetos interessantes."
Notícias Relacionadas
Central a relação dos maxilares: definição, métodos
ortopédicas de odontologia utiliza o termo "oclusão". Sob a entender heel-and-toe de dentes. Existem 4 principais oclusão e uma infinidade de intermediários. As primeiras incluem central, frontal e 2 laterais. Central de oclusão é...
Qual foi a atitude do Bloco para a revolução de 1917?
Quem quer que não apenas foi Alexander Bloco - poeta, escritor, relações públicas, dramaturgo, tradutor, crítico literário. Além disso, А. А. Bloco - um dos clássicos da literatura russa do século xx. É impensável russo simbolismo...
"É pequeno pequeno de menos": o valor фразеологизма
Фразеологизмы - essenciais e brilhante discurso, expressões. Muitos deles se formaram em alemão há muito tempo desatualizado que as palavras em sua programação, já que dificultem a compreensão do sentido, embora o próprio sustentá...
Conflitos interpessoais: a natureza, as causas e tipologia de
conflitos Interpessoais representam os conflitos que ocorrem no setor de pessoas no processo psicológico e interação social. A partir dessa compreensão, torna-se claro que, em qualquer sociedade, a probabilidade de sua ocorrência ...
Quantas letras no alfabeto inglês e como lê-los
Então, se é importante saber quantas letras no alfabeto inglês? neste artigo, vamos dar a resposta a esta questão, e também осветим outros pontos importantes.Interessado em saberneste alfabeto de 26 caracteres, e para a ...
Onde está Cartago e qual é a sua marca na história?
a Antiga Cartago – um dos poucos estados que caiu verdadeiro desafio legiões romanas, no terceiro século antes de nossa era. A vitória de Roma levou no final de sua civilização a блестящему grandeza, e Cartago foi injustamen...




















Comentários (0)
Este artigo possui nenhum comentário, seja o primeiro!