Now - 16:48:37
Вуглярод - гэта... Атам вугляроду. Маса вугляроду
Адным з самых дзіўных элементаў, які здольны фармаваць велізарную колькасць разнастайных злучэнняў арганічнай і неарганічнай прыроды, з'яўляецца вуглярод. Гэта настолькі незвычайны па ўласцівасцях элемент, што яшчэ Мендзялееў прадракаў яму вялікую будучыню, кажучы пра не раскрытых пакуль асаблівасцях.
Пазней гэта пацвердзілася практычна. Стала вядома, што ён - галоўны біягенных элемент нашай планеты, які ўваходзіць у склад абсалютна ўсіх жывых істот. Акрамя гэтага, здольны існаваць у такіх формах, якія кардынальна адрозніваюцца па ўсіх параметрах, але пры гэтым складаюцца толькі з атамаў вугляроду.
У увогуле, асаблівасцяў ў гэтай структуры шмат, менавіта з імі і пастараемся разабрацца ў ходзе артыкулы.
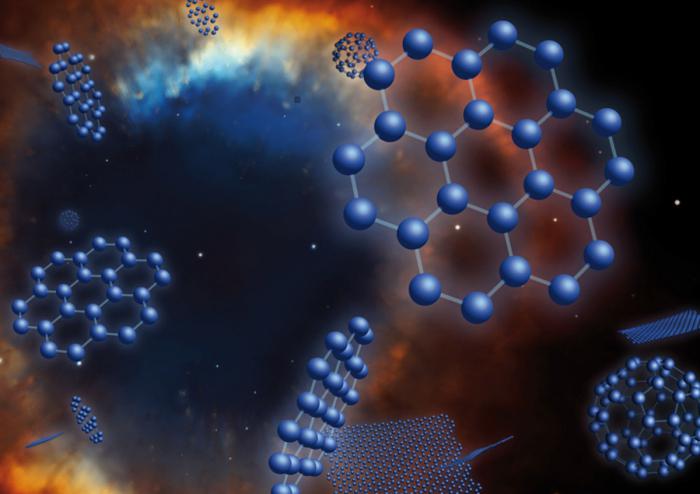
Вуглярод: формула і становішча ў сістэме элементаў
У перыядычнай сістэме элемент вуглярод размяшчаецца ў IV (па новаму ўзору ў 14) групе, галоўнай падгрупе. Яго парадкавы нумар 6, а атамны вага 12,011. Абазначэнне элемента знаёмы З кажа аб яго назве на латыні - carboneum. Ёсць некалькі розных формаў, у якіх існуе вуглярод. Формула яго таму бывае розная і залежыць ад канкрэтнай мадыфікацыі.
Аднак для напісання ураўненняў рэакцый канкрэтнае абазначэнне, вядома, ёсць. У цэлым, калі гаворыцца аб рэчыве ў чыстым выглядзе, прынятая малекулярная формула вугляроду З, без індэксацыі.
Гісторыя адкрыцця элемента
Сам па сабе гэты элемент вядомы з самай старажытнасці. Бо адзін з галоўных мінералаў у прыродзе - гэта каменны вугаль. Таму для старажытных грэкаў, рымлян і іншых народнасцяў сакрэтам ён не быў.
Больш:
Нервовы імпульс, яго пераўтварэнне і механізм перадачы
Нервовая сістэма чалавека выступае своеасаблівым каардынатарам у нашым арганізме. Яна перадае каманды ад мозгу мускулатуры, органаў, тканін і апрацоўвае сігналы, якія ідуць ад іх. У якасці своеасаблівага носьбіта дадзеных выкарыстоўваецца нервовы імп...
Куды паступаць пасля 11 класа? Якую выбраць прафесію?
Пры выбары сваёй будучай прафесіі не варта абапірацца на чые-то рэкамендацыі і парады, тым больш не трэба падпарадкоўвацца сваім бацькам, якія даволі часта вырашаюць без вас самастойна, куды паступіць пасля 11 класа. Варта задумацца, наколькі паспяхо...
Крывяносная сістэма жывёл, як вынік эвалюцыйнага развіцця свету
Крывяносная сістэма жывёл прайшла доўгі шлях фарміравання ў ходзе эвалюцыйнага развіцця свету. Яна ўтварылася на месцы рудыментарных частак першаснай паражніны цела, якая ў вышэйшых жывёл была выцесненая целломом, або другаснай паражніной цела. У пра...
Акрамя гэтай разнавіднасці, таксама выкарыстоўвалі алмазы і графіт. З апошнім доўгі час было шмат заблытаных сітуацый, так як часта без аналізу складу за графіт прымалі такія злучэння, як:
- серабрысты свінец;
- карбід жалеза;
- сульфід малібдэна.
Усе яны былі пафарбаваны ў чорны колер і таму лічыліся графітам. Пазней гэта непаразуменне было растлумачана, і дадзеная форма вугляроду стала сама сабой.
З 1725 года вялікае камерцыйнае значэнне набываюць алмазы, а ў 1970 засвоеная тэхналогія атрымання іх штучным шляхам. З 1779 года, дзякуючы працам Карла Шэель, вывучаюцца хімічныя ўласцівасці, якія праяўляе вуглярод. Гэта паслужыла пачаткам шэрагу найважнейшых адкрыццяў у вобласці дадзенага элемента і стала асновай для высвятлення ўсіх яго унікальных асаблівасцяў.

Ізатопы вугляроду і распаўсюджванне ў прыродзе
Нягледзячы на тое, што разгляданы элемент - адзін з найважнейшых біягенных, яго агульнае ўтрыманне ў масе зямной кары складае 0,15 %. Так адбываецца ад таго, што ён падвяргаецца пастаяннай цыркуляцыі, натуральнага кругазвароту ў прыродзе.
У цэлым можна назваць некалькі злучэнняў мінеральнага характару, у склад якіх уваходзіць вуглярод. Гэта такія прыродныя пароды, як:
- даламіты і вапнякі;
- антрацыт;
- гаручыя сланцы;
- прыродны газ;
- каменны вугаль;
- нафту;
- буры вугаль;
- торф;
- бітумы.
Акрамя гэтага, не варта забываць і пра жывых істотах, якія з'яўляюцца проста сховішчам вугляродных злучэнняў. Бо ім ўтвораны вавёркі, тлушчы, вугляводы, нуклеінавыя кіслаты, а значыць самыя жыццёва важныя структурныя малекулы. У цэлым на пералік сухі масы цела з 70 кг 15 прыходзіцца на чысты элемент. І так у кожнага чалавека, не кажучы ўжо пра жывёл, раслінах і іншых істотах.
Калі ж разгледзець склад паветра і вады, то ёсць гідрасферу ў цэлым і атмасферу, то тут прысутнічае сумесь вуглярод-кісларод, выражаемая З формулай2. Дыяксід або вуглякіслы газ - адзін з асноўных газаў, якія складаюць паветра. Менавіта ў такім выглядзе масавая доля вугляроду складае 0,046%. Яшчэ больш растворана вуглякіслага газу ў водах Сусветнага акіяна.
Атамная маса вугляроду як элемента складае 12,011. Вядома, што дадзеная велічыня разлічваецца як сярэдняе арыфметычнае паміж атамнымі вагамі ўсіх існуючых у прыродзе ізатопных разнавіднасцяў, з улікам іх распаўсюджанасці (у працэнтных суадносінах). Так адбываецца і ў разгляданага рэчывы. Ёсць тры галоўных ізатопа, у выглядзе якіх знаходзіцца вуглярод. Гэта:
- 12З - яго масавая доля ў пераважнай большасці складае 98,93 %;
- 13З - 1,07 %;
- 14З - радыеактыўны, перыяд паўраспаду 5700 гадоў, ўстойлівы бэці-выпраменьвальнік.
У практыцы вызначэння геохронологического ўзросту узораў шырока ўжываецца радыеактыўны ізатоп 14З, які з'яўляецца індыкатарам, дзякуючы свайму працягламу перыяду распаду.

Аллотропные мадыфікацыі элемента
Вуглярод - гэта такі элемент, які ў выглядзе простага рэчывы існуе ў некалькіх формах. Гэта значыць ён здольны фармаваць самае вялікае з вядомых на сёння колькасць аллотропных мадыфікацый.
1. Крышталічныя варыяцыі - існуюць у выглядзе трывалых структур з правільнымі рашоткамі атамнага тыпу. Да дадзенай групы ставяцца такія разнавіднасці, как:
- алмазы;
- фуллерены;
- графиты;
- карбины;
- лонсдейлиты;
- вугляродныя валакна і трубкі.
Усе яны адрозніваюцца будовай крышталічнай рашоткі, у вузлах якіх - атам вугляроду. Адсюль і цалкам унікальныя, не падобныя ўласцівасці, як фізічныя, так і хімічныя.
2. Аморфныя формы - іх ўтварае атам вугляроду, які ўваходзіць у складнекаторых прыродных злучэнняў. То бок, гэта не чыстыя разнавіднасці, а з прымешкамі іншых элементаў у нязначнай колькасці. У дадзеную групу ўваходзяць:
- актываваны вугаль;
- каменны і драўняны;
- сажа;
- вугляродная нанопена;
- антрацыт;
- стеклоуглерод;
- тэхнічная разнавіднасць рэчывы.
Іх таксама аб'ядноўваюць асаблівасці будовы крышталічнай рашоткі, якія тлумачаць і проявляемые ўласцівасці.
3. Злучэння вугляроду ў выглядзе кластараў. Такая структура, пры якой атамы замыкаюцца ў асаблівую полую знутры канфармацыя, запаўняцца вадой або ядрамі іншых элементаў. Прыклады:
- вугляродныя наноконусы;
- астралены;
- диуглерод.

Фізічныя ўласцівасці аморфнага вугляроду
З-за вялікага разнастайнасці аллотропных мадыфікацый, вылучыць нейкія агульныя фізічныя ўласцівасці для вугляроду складана. Прасцей казаць аб канкрэтнай форме. Так, напрыклад, аморфны вуглярод валодае наступнымі характарыстыкамі.
- У аснове ўсіх формаў - мелкокристаллические разнавіднасці графіту.
- Высокая цеплаёмістасць.
- Добрыя проводниковые ўласцівасці.
- Шчыльнасць вугляроду каля 2 г/см3.
- Пры награванні звыш 1600 0З адбываецца пераход у графітавыя формы.
Сажа, драўняны вугаль і каменныя разнавіднасці знаходзяць шырокае прымяненне ў тэхнічных мэтах. Яны не з'яўляюцца праявай мадыфікацыі вугляроду ў чыстым выглядзе, аднак ўтрымліваюць яго ў вельмі вялікай колькасці.
Крышталічны вуглярод
Існуе некалькі варыянтаў, у якіх вуглярод - рэчыва, фарміруючы правільныя крышталі рознага выгляду, дзе атамы злучаюцца паслядоўна. У выніку адбываецца адукацыя наступных мадыфікацый.
- Алмаз. Структура - кубічная, у якой злучаюцца чатыры тэтраэдра. У выніку ўсе кавалентным хімічныя сувязі кожнага атама максімальна насычаным і трывалыя. Гэта тлумачыць фізічныя ўласцівасці: шчыльнасць вугляроду 3300 кг/м3. Высокая цвёрдасць, нізкая цеплаёмістасць, адсутнасць электрычнай праводнасці - усё гэта з'яўляецца вынікам будовы крышталічнай рашоткі. Існуюць тэхнічна атрыманыя алмазы. Ўтвараюцца пры пераходзе графіту ў наступную мадыфікацыю пад уплывам высокай тэмпературы і пэўнага ціску. У цэлым тэмпература плаўлення алмаза гэтак жа высокая, як і трываласць - каля 3500 0С.
- Графіт. Атамы размешчаны падобна структуры папярэдняга рэчывы, аднак адбываецца насычэнне толькі трох сувязяў, а чацвёртая становіцца больш доўгай і менш трывалай, яна злучае паміж сабой "пласты" гексаганальных кольцаў рашоткі. У выніку атрымліваецца, што графіт - мяккае, тлусты навобмацак рэчыва чорнага колеру. Валодае добрай электрычнай праводнасцю і мае высокую тэмпературу плаўлення - 3525 0С. Здольна да сублімацыі - возгонке з цвёрдага стану ў газападобнае, абыходзячы вадкае (пры тэмпературы 3700 0З). Шчыльнасць вугляроду - 2,26 г/см3, што значна ніжэй такой у алмаза. Гэта тлумачыць іх розныя ўласцівасці. З-за слаістай структуры крышталічнай рашоткі, магчыма выкарыстанне графіту для вырабу грифелей простых алоўкаў. Пры правядзенні па паперы лускавінкі адслойваюцца і пакідаюць на паперы след чорнага колеру.
- Фуллер. Адкрыты былі толькі ў 80-х гадах мінулага стагоддзя. Ўяўляюць сабой мадыфікацыі, у якіх углероды злучаюцца паміж сабой у асаблівую выпуклую замкнёную структуру, якая мае ў цэнтры пустэчу. Прычым форма крышталя - шматграннік, правільнай арганізацыі. Цотная колькасць атамаў. Самая вядомая форма фуллер З60. Ўзоры падобнага рэчывы былі знойдзеныя пры даследаваннях:
- метэарытаў;
- донных адкладаў;
- фольгуритов;
- шунгитов;
- касмічнай прасторы, дзе ўтрымліваліся ў выглядзе газаў.
Усе разнавіднасці крышталічнага вугляроду маюць важнае практычнае значэнне, паколькі валодаюць побач карысных у тэхніцы уласцівасцяў.
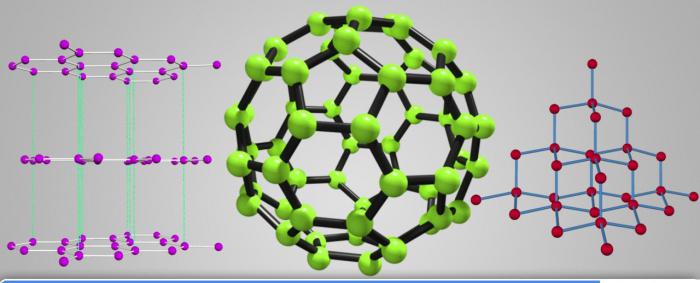
Хімічная актыўнасць
Малекулярны вуглярод выяўляе нізкую хімічную актыўнасць з прычыны сваёй устойлівай канфігурацыі. Прымусіць яго ўступаць у рэакцыі можна толькі паведаміўшы атаму дадатковую энергію і прымусіўшы электроны вонкавага ўзроўню распарыць. У гэты момант валентнасць становіцца роўная 4. Таму ў злучэннях ён мае ступень акіслення + 2, + 4, - 4.
Практычна ўсе рэакцыі з простымі рэчывамі, як металамі, так і неметаллов, працякаюць пад уплывам высокіх тэмператур. Разгляданы элемент можа быць як акісляльнікам, так і адраджэнцам. Аднак апошнія ўласцівасці выяўленыя ў яго асабліва моцна, менавіта на гэтым заснавана прымяненне яго ў металургічнай і іншых галінах прамысловасці.
У цэлым здольнасць ўступаць у хімічнае ўзаемадзеянне залежыць ад трох фактараў:
- дысперснасці вугляроду;
- аллотропной мадыфікацыі;
- тэмпературы рэакцыі.
Такім чынам, у шэрагу выпадкаў адбываецца ўзаемадзеянне з наступнымі рэчывамі:
- неметаллов (вадародам, кіслародам);
- металамі (алюмініем, жалезам, кальцыем і іншымі);
- аксідамі металаў і іх солямі.
З кіслотамі і шчолачамі не рэагуе, з галагенных вельмі рэдка. Найважнейшая з уласцівасцяў вугляроду - здольнасць ўтвараць доўгія ланцугі паміж сабой. Яны могуць замыкацца ў цыкл, фарміраваць разгалінавання. Так адбываецца адукацыя арганічных злучэнняў, якія на сённяшні дзень вылічаюцца мільёнамі. Аснова гэтыхзлучэнняў два элемента - вуглярод, вадарод. Таксама ў склад могуць уваходзіць і іншыя атамы: кісларод, азот, сера, галагены, фосфар, металы і іншыя.
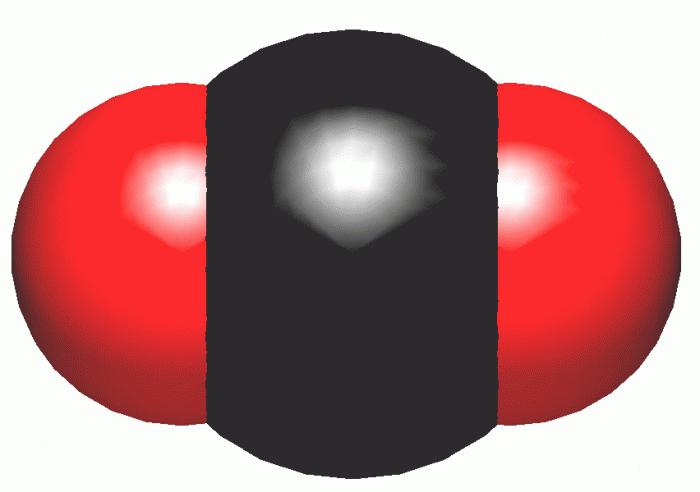
Асноўныя злучэння і іх характарыстыка
Існуе мноства розных злучэнняў, у склад якіх уваходзіць вуглярод. Формула самага вядомага з іх - СА2 - вуглякіслы газ. Аднак акрамя гэтага аксіду, існуе яшчэ З - монааксід або угарны газ, а таксама недооксид З3Аб2.
Сярод соляў, у склад якіх уваходзіць дадзены элемент, самымі распаўсюджанымі з'яўляюцца карбанаты кальцыя і магнію. Так, карбанат кальцыя мае некалькі сінонімаў у назве, так як у прыродзе сустракаецца ў выглядзе:
- мелу;
- мармуру;
- вапняка;
- даламіту.
Важнае значэнне карбанатаў щелочноземельных металаў выяўляецца ў тым, што яны актыўныя ўдзельнікі працэсаў адукацыі сталактытаў і сталагміты, а таксама падземных вод.
Вугальная кіслата - яшчэ адно злучэнне, якое ўтварае вуглярод. Формула яе - Н2З3. Аднак у звычайным выглядзе яна вельмі няўстойлівая і адразу ж у растворы распадаецца на вуглякіслы газ і ваду. Таму вядомыя толькі яе солі, а не яна сама, як раствор.
Галагенід вугляроду - атрымліваюцца ў асноўным ўскосным шляхам, так як прамыя синтезы ідуць толькі пры вельмі высокіх тэмпературах, і з нізкім выхадам прадукту. Адно з самых распаўсюджаных - CCL4 - тетрахлорметан. Атрутнае злучэнне, здольнае пры ўдыханні выклікаць атручванне. Атрымліваюць пры рэакцыях радыкальнага фотахімічныя замяшчэння атамаў вадароду ў метане.
Карбід металаў - злучэнні вугляроду, у якіх ён праяўляе ступень акіслення 4. Таксама магчыма існаванне аб'яднанняў з борам і крэмніем. Галоўнае ўласцівасць карбідам некаторых металаў (алюмінія, вальфраму, тытана, ніёбія, тантал, гафнія) - гэта высокая трываласць і выдатная электраправоднасць. Карбід бора Ў4З - адно з самых цвёрдых рэчываў пасля алмаза (9,5 па Мооса). Дадзеныя злучэння выкарыстоўваюцца ў тэхніцы, а таксама хімічнай прамысловасці, як крыніцы атрымання вуглевадародаў (карбід кальцыя з вадой прыводзіць да адукацыі ацэтылену і гідраксіду кальцыя).
Многія сплавы металаў вырабляюць з выкарыстаннем вугляроду, значна павышаючы тым самым іх якасныя і тэхнічныя характарыстыкі (сталь - сплаў жалеза з вугляродам).
Асобнай увагі заслугоўваюць шматлікія арганічныя злучэнні вугляроду, у якіх ён - асноватворны элемент, здольны злучацца з такімі ж атамамі ў доўгія ланцугі рознага будынкі. Да іх можна аднесці:
- алкаеў;
- алкены;
- арэны;
- вавёркі;
- вугляводы;
- нуклеінавыя кіслаты;
- спірты;
- карбонавыя кіслоты і многія іншыя класы рэчываў.
Ужыванне вугляроду
Значэнне злучэнняў вугляроду і яго аллотропных мадыфікацый у жыцці чалавека вельмі вяліка. Можна назваць некалькі самых глабальных галін, каб стала зразумела, што гэта сапраўды так.
- Дадзены элемент ўтварае усе віды арганічнага паліва, з якога чалавек атрымлівае энергію.
- Металургічная прамысловасць выкарыстоўвае вуглярод як моцны аднаўляльнік для атрымання металаў з іх злучэнняў. Тут жа знаходзяць шырокае прымяненне карбанаты.
- Будаўніцтва і хімічная прамысловасць спажываюць велізарную колькасць злучэнняў вугляроду для сінтэзу новых рэчываў і атрымання неабходных прадуктаў.

Таксама можна назваць такія галіны гаспадаркі, як:
- ядзерная прамысловасць;
- ювелірнае справа;
- тэхнічнае абсталяванне (змазкі, гарачатрывалыя ціглі, алоўкі і іншае);
- вызначэнне геалагічнага ўзросту парод - радыеактыўны індыкатар 14;
- вуглярод - выдатны адсарбент, што дазваляе выкарыстоўваць яго для вырабу фільтраў.
Кругазварот у прыродзе
Маса вугляроду, які знаходзіцца ў прыродзе, ўключана ў пастаянны кругазварот, які цыклічна штосекундна здзяйсняецца па ўсім зямным шары. Так, атмасферны крыніца вугляроду - СА2, паглынаецца раслінамі і вылучаецца усімі жывымі істотамі ў працэсе дыхання. Трапляючы ў атмасферу, ён зноў паглынаецца, і так цыкл не спыняецца. Пры гэтым адміранне арганічных рэшткаў прыводзіць да вызваленню вугляроду і назапашвання яго ў зямлі, адкуль затым ён зноў паглынаецца жывымі арганізмамі і выводзіцца ў атмасферу ў выглядзе газу.
Article in other languages:
AR: https://tostpost.com/ar/education/1741-carbon-is-carbon-atom-weight-of-carbon.html
En: https://tostpost.com/education/18145-carbon-is-carbon-atom-weight-of-carbon.html
ES: https://tostpost.com/es/la-educaci-n/3022-el-carbono-es-el-tomo-de-carbono-masa-de-carbono.html
HI: https://tostpost.com/hi/education/1741-carbon-is-carbon-atom-weight-of-carbon.html
JA: https://tostpost.com/ja/education/1740-carbon-is-carbon-atom-weight-of-carbon.html
KK: https://tostpost.com/kk/b-l-m/3020-k-m-rtek---b-l-atom-k-m-rtek-bolady-massasy-k-m-rteg.html
PL: https://tostpost.com/pl/edukacja/3023-w-giel---to-atom-w-gla-masa-w-gla.html
PT: https://tostpost.com/pt/educa-o/3020-o-carbono-um-tomo-de-carbono-a-massa-de-carbono.html
TR: https://tostpost.com/tr/e-itim/3025-karbon---bu-karbon-atomu-a-rl-k-karbon.html
UK: https://tostpost.com/uk/osv-ta/3022-vuglec---ce-atom-vuglecyu-masa-vuglecyu.html

Alin Trodden - аўтар артыкула, рэдактар
"Прывітанне, Я Алін Тродден. Я пішу тэксты, чытаю кнігі і шукаю ўражанні. І я нядрэнна ўмею распавядаць вам пра гэта. Я заўсёды рады ўдзельнічаць у цікавых праектах."
Навіны
Маштабы Сусвету, будынак, аб'екты
Былі часы, калі свет людзей абмяжоўваўся паверхняй Зямлі, якая знаходзіцца ў іх пад нагамі. Па меры развіцця тэхнікі чалавецтва пашырыла свой кругагляд. Цяпер людзі задумваюцца аб тым, ці ёсць межы ў нашага свету і якія маштабы Су...
Паўднёвы полюс і яго заваяванне. Якую геаграфічную шырату мае Паўднёвы полюс?
На планеце ёсць дзве кропкі, якія найбольш удаленны ад лініі экватара. Гэта Паўночны полюс і Паўднёвы полюс. І калі першы размешчаны пасярод змёрзлага акіяна, то другі знаходзіцца на цьвердзі гэтага мацерыка. Менавіта яму і прысве...
Крымская вайна: коратка аб прычынах і последсвиях
Крымская вайна, коратка пра якую пойдзе гаворка ніжэй у артыкуле, стала пераходным момантам для рускіх людзей. Звязана гэта, перш за ўсё, з яе вынікамі. Народ і ўлада ўсведамляюць неабходнасць пераўтварэнняў у краіне. Сумныя вынік...
Прыназоўнікі невытворных і вытворныя: правіла, спіс, прыклады
Вытворны і непроизводный падстава, у першую чаргу, з'яўляецца службовай часткай гаворкі. Ён звязвае словы паміж сабою і паказвае іх залежнасць адзін ад аднаго. Асобна выкарыстоўвацца прыназоўнікі не могуць, яны заўсёды стаяць каля...
Хто такі Міхаіл Васільевіч Ламаносаў: біяграфія і творчасць
Толькі несуцішная запал да ведаў дапамагла сыну селяніна стаць заснавальнікам такіх напрамкаў навукі, як прыродазнаўства, хімія, астраномія, прыборабудаванне, геаграфія, металургія, геалогія, філалогія. Ламаносаў - адзін з самых я...
Адраджэнне: што такое Рэнесанс і якія яго наступствы?
Гісторыя Еўропы ведае некалькі паваротных падзей і з'яў, якія цалкам мянялі карціну свету яе жыхароў. Адным з такіх межаў стала Адраджэнне. Што такое Рэнесанс (гэтыя тэрміны раўназначныя)?Асноўныя рысы РэнесансуАдраджэннем называю...





















Заўвага (0)
Гэтая артыкул не мае каментароў, будзьце першым!