Now - 20:56:56
Якая валентнасць ў кіслароду ў злучэннях?
Для таго каб вызначыць магчымыя значэнні валентнасці кіслароду, варта вывучыць становішча элемента ў перыядычнай табліцы, асноўныя рысы яго будовы атама. Такі падыход зручны пры вывучэнні пытання аб тым, якая валентнасць у кіслароду тыповая, а якая для яго нехарактэрна. У найбольш распаўсюджаных злучэннях выяўляецца звычайная валентнасць — II. Гэтая асаблівасць дазваляе вызначаць колькасць сувязяў іншага атама ў гатовых бінарных формулах з удзелам кіслароду.
Якая валентнасць кіслароду ў?
На першапачатковым этапе назапашвання ведаў аб уласцівасцях і будове рэчываў хімікі думалі, што валентнасць — гэта здольнасць звязваць пэўную колькасць атамаў ў малекулу рэчывы. Многія навукоўцы пасля адкрыцця элемента спрабавалі зразумець, якая валентнасць у кіслароду. Адказ быў атрыманы эксперыментальным шляхам: кісларод далучае у хімічнай рэакцыі два атама одновалентного вадароду, значыць, двухвалентен. Ўяўленні аб хімічнай сувязі мяняліся па меры назапашвання ведаў аб будове рэчыва. У сваёй тэорыі валентнасці Г. Льюіс і. В. Коссель раскрываюць сутнасць хімічнага ўзаемадзеяння з пункту гледжання электроннага будынка. Даследчыкі тлумачылі здольнасць атама да адукацыі пэўнага колькасці сувязяў імкненнем да найбольш ўстойлівым энергетычным стане. У выпадку яго дасягненні найменшая часціца рэчывы становіцца больш стабільнай. У тэорыі і структурах Люіса вялікая ўвага надаецца ролі знешніх электронаў, якія прымаюць удзел у стварэнні хімічнай сувязі.
Асаблівасці размяшчэння кіслароду ў перыядычнай табліцы
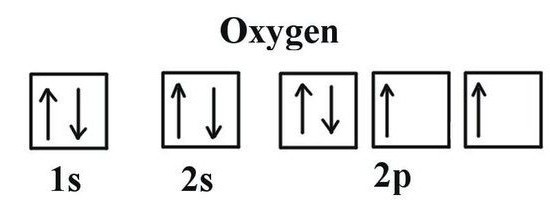
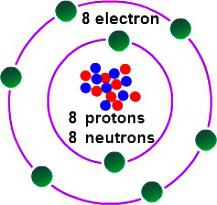
Для таго каб вызначыць, якая валентнасць у кіслароду, неабходна разгледзець некаторыя асаблівасці яго электроннага будынка. Кісларод ўзначальвае 16 групу перыядычнай табліцы. Трывіяльнае назва сямейства элементаў — «халькогены», па састарэлай класіфікацыі яны ставяцца да VI(А) групе. У перыядычным табліцы кісларод знаходзіцца ў вочку пад №8. Ядро змяшчае ў сваім складзе 8 станоўчых і столькі ж нейтральных элементарных часціц. У прасторы атама налічваецца два энергетычных ўзроўню, якія ўзнікаюць пры руху 8 электронаў, з якіх 6 — знешнія.
Больш:
Нервовы імпульс, яго пераўтварэнне і механізм перадачы
Нервовая сістэма чалавека выступае своеасаблівым каардынатарам у нашым арганізме. Яна перадае каманды ад мозгу мускулатуры, органаў, тканін і апрацоўвае сігналы, якія ідуць ад іх. У якасці своеасаблівага носьбіта дадзеных выкарыстоўваецца нервовы імп...
Куды паступаць пасля 11 класа? Якую выбраць прафесію?
Пры выбары сваёй будучай прафесіі не варта абапірацца на чые-то рэкамендацыі і парады, тым больш не трэба падпарадкоўвацца сваім бацькам, якія даволі часта вырашаюць без вас самастойна, куды паступіць пасля 11 класа. Варта задумацца, наколькі паспяхо...
Крывяносная сістэма жывёл, як вынік эвалюцыйнага развіцця свету
Крывяносная сістэма жывёл прайшла доўгі шлях фарміравання ў ходзе эвалюцыйнага развіцця свету. Яна ўтварылася на месцы рудыментарных частак першаснай паражніны цела, якая ў вышэйшых жывёл была выцесненая целломом, або другаснай паражніной цела. У пра...

Якая існуе залежнасць паміж складам атама і валентны?
На апошнім узроўні атама кіслароду ўтрымліваюцца 2 неспаренных электрона. Элемент саступае фторам па значэнні электраадмо (здольнасці прыцягваць да сабе якія злучаюць электронныя пары). Пры адукацыі злучэнняў з іншымі элементамі кісларод прыцягвае да сябе узніклую ў малекуле агульную электронную шчыльнасць (акрамя электронаў фтору). Дасягненне ўстойлівага стану знешняй абалонкі магчыма пры даданні двух адмоўных зарадаў. Гэта азначае, што кіслароду патрабуецца 2 электрона. Магчымыя наступныя варыянты: прыняць адзін электрон (валентнасць II), адабраць у іншага атама 2 электрона (валентнасць II), не прымаць электроны ад іншых атамаў (валентнасць 0). Тыповая паводзіны кіслароду характарызуе другі выпадак. Гэтым спосабам можна скарыстацца, каб даведацца, якая валентнасць кіслароду ў найбольш тыповая ў яго распаўсюджаных злучэннях. Да такіх адносіцца большасць аксідаў металаў і неметаллов.
Як выяўляецца валентнасць ў злучэннях?
Кісларод здольны непасрэдна ўзаемадзейнічаць з многімі хімічнымі элементамі. Вядомыя яго злучэння практычна з усімі прадстаўнікамі табліцы Мендзялеева (за выключэннем інэртных газаў: аргону, гелія, неону). У рэакцыю з галагенных, высакароднымі металамі кісларод можа непасрэдна не ўступаць, але аксіды Au2O3, F2O, Cl2O7 існуюць і іншыя (атрымліваюць ўскосна). Для бінарных злучэнняў, у адукацыі якіх прымае ўдзел кісларод, характэрныя кавалентная сувязь і палярнасць. Валентнасць у такіх малекулах залежыць ад колькасці якія ўзніклі пар электронаў, да якіх прыцягваюцца ядра розных атамаў. У пераважнай большасці злучэнняў атамы кіслароду ўдзельнічаюць у стварэнні двух кавалентных сувязяў. Напрыклад, у оксидах СА2, Р2Аб5, SO2, SO3,2, У2Аб3, Мо2Аб5 і ў іншых малекулах. У катионе гидроксония Н3Аб+ кісларод праяўляе нетыповую для яго валентнасць III. Наяўнасцю пероксогруппы –—У– абумоўлены незвычайны характар пераксіду вадароду Н2Аб2. У гэтым злучэнні кісларод праяўляе уласцівую яму валентнасць II.
Як вызначыць валентнасць элементаў?
Ўяўленне аб валентных магчымасцях кіслароду дае структура Люіса — хімічны знак элемента, вакол якога кропкамі адзначаюць электроны вонкавага пласта. Менавіта яны прымаюць удзел у стварэнні малекул, якія ўваходзяць у склад агульных электронных пар. Формула Люіса наглядна дэманструе валентнасць кіслароду, адпаведную колькасці яго неспаренных электронаў (2). Такі ж вынік дае выкарыстанне графічных электронных структур. У двух вочках знешняга энергетычнага ўзроўню кіслароду размешчаны неспараныя электроны (пазначаныя ў формуле стрэлачкамі). Звесткі аб тым, якая валентнасць у кіслароду,дазваляюць вызначыць па гатовай формуле бінарнага злучэння значэнне для суседніх атамаў. Для гэтага праводзяць нескладаныя разлікі. Спачатку памнажаюць лік атамаў Аб на паказчык звычайнай для валентнасці кіслароду. Атрыманае значэнне трэба падзяліць на той індэкс, што паказаны ў формуле побач з хімічным сімвалам іншага элемента ў злучэнні з кіслародам. Пры дапамозе простага спосабу падлічым валентнасць вугляроду і фосфару ў іх оксидах.
- Памножым індэкс справа ўнізе ад знака Аб у диоксиде СА2 на тыповую валентнасць элемента: 2 • 2 = 4. Атрыманае лік падзелім на індэкс, паказаны для вугляроду: 4/1 = 4. У диоксиде СА2 вуглярод знаходзіцца ў сваім вышэйшым валентном стане IV.
- Індэкс унізе справа ад хімічнага сімвала кіслароду ў аксіду фосфару Р2Аб5 памножым на тыповую валентнасць атама Аб: 5 • 2 = 10. Гэта лік падзелім на ўказаны ў формуле індэкс справа ўнізе ад атаму фосфару: 10/2 = 5. У аксіду фосфар знаходзіцца ў стане сваёй вышэйшай валентнасці V.
Article in other languages:
AR: https://tostpost.com/ar/education/3230-what-is-the-valence-of-oxygen-in-compounds.html
DE: https://tostpost.com/de/bildung/5703-welche-wertigkeit-haben-sauerstoff-in-den-gelenken.html
En: https://tostpost.com/education/18337-what-is-the-valence-of-oxygen-in-compounds.html
ES: https://tostpost.com/es/la-educaci-n/5708-qu-valencia-el-ox-geno-en-las-conexiones.html
HI: https://tostpost.com/hi/education/3232-valence.html
JA: https://tostpost.com/ja/education/3231-what-is-the-valence-of-oxygen-in-compounds.html
KK: https://tostpost.com/kk/b-l-m/5705-anday-valentnost-u-otteg-osylystarda.html
PT: https://tostpost.com/pt/educa-o/5704-qual-a-val-ncia-perto-de-oxig-nio-nas-liga-es.html
TR: https://tostpost.com/tr/e-itim/5709-ne-de-erlik-atlayabilirsiniz-var-oksijen-bile-ikleri.html
UK: https://tostpost.com/uk/osv-ta/5707-yaka-valentn-st-u-kisnyu-v-spolukah.html
ZH: https://tostpost.com/zh/education/3479-what-is-the-valence-of-oxygen-in-compounds.html

Alin Trodden - аўтар артыкула, рэдактар
"Прывітанне, Я Алін Тродден. Я пішу тэксты, чытаю кнігі і шукаю ўражанні. І я нядрэнна ўмею распавядаць вам пра гэта. Я заўсёды рады ўдзельнічаць у цікавых праектах."
Навіны
Кадэцкія вучылішча ў Арэнбургу, Краснадары, Цюмені, Стаўрапалі
У чэрвені 2014 года адбылося знамянальная падзея ў жыцці Расіі – у Арэнбургу прайшоў першы выпуск прэзідэнцкага кадэцкага вучылішча. Створана яно было ў жніўні 2010 года, за ўсё ў нашай краіне адкрыта чатыры такіх навучальны...
Тамільская мова. Дравідыйскіх сям'я моў
Тамільская мова з'яўляецца адным з моў дравідыйскіх групы. Ён шырока распаўсюджаны ў паўднёвай Індыі, з'яўляецца адным з афіцыйных у гэтай краіне. Унікальная старажытнасць гэтай мовы, яго непасрэдная сувязь з багатай культурай Інд...
Бацькоўскі дом - гэта... Аргументы і развагі. Сачыненне на тэму: "Бацькоўскі дом - пачатак пачаткаў"
Нярэдка ў школах, ліцэях, каледжах і нават вну вучням задаюць напісаць сачыненне на тэму “Бацькоўскі дом”. Гэта вельмі добрая праца, над якой кожнаму варта было б папрацаваць. Бо тэма вельмі важная. Для ўсіх. У кожнага...
Нас заўсёды і ўсюды акружае святло, так як гэта неад'емная частка жыцця. Агонь, сонца, месяц або настольная лямпа – гэта ўсё адносіцца да дадзенай катэгорыі. Цяпер нашай задачай будзе разгледзець натуральныя і штучныя крыніц...
План сачынення: важны і неабходны
Вучоба ў школе – час шчаслівае і адносна бесклапотнае. Але так скажуць тыя, хто мае выдатную паспяховасць. Такім вучням нічога не варта даказаць тэарэму, паставіць хімічны вопыт або разабрацца, як пісаць сачыненні. Але больш...
Абарыгены ведалі, што адкрыў Калумб!
Асоба Хрыстафора Калумба да гэтага часу абвеяная загадкамі. Навукоўцы да нашых часоў не вызначыліся з датай і месцам яго нараджэння. На ролю радзімы прэтэндавала 14 гарадоў. Але працэс цяжбы яшчэ не скончаны, барацьба працягваецца...















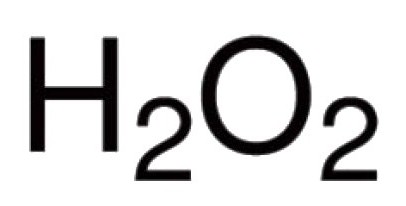






Заўвага (0)
Гэтая артыкул не мае каментароў, будзьце першым!