Кіслародзмяшчальныя злучэння: прыклады, уласцівасці, формулы
Адзін з найбольш распаўсюджаных хімічных элементаў, які ўваходзіць у пераважная большасць хімічных рэчываў – гэта кісларод. Аксіды, кіслоты, падставы, спірты, фенолы і іншыя кіслародзмяшчальныя злучэння вывучаюцца ў курсе неарганічнай і арганічнай хіміі. У нашай артыкуле мы вывучым ўласцівасці, а таксама прывядзем прыклады іх прымянення ў прамысловасці, сельскай гаспадарцы і медыцыне.
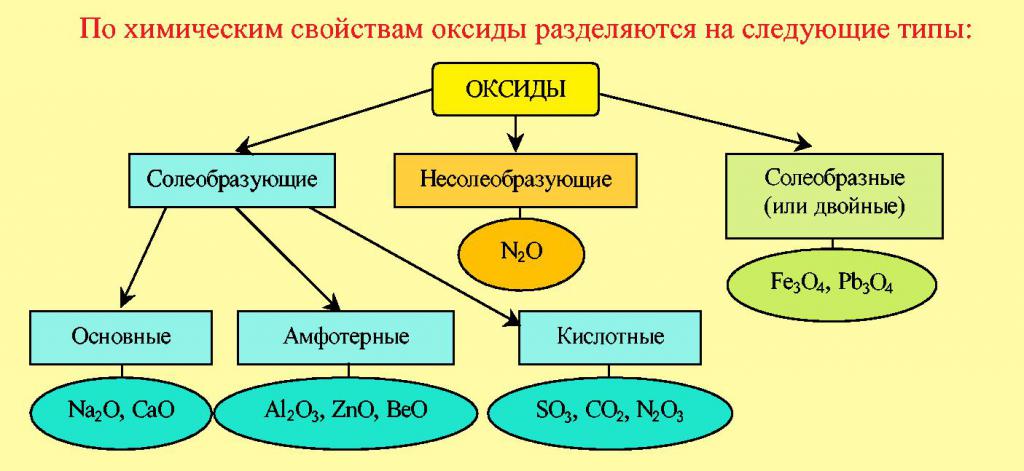
Аксіды
Найбольш простымі па будове з'яўляюцца бінарныя злучэння металаў і неметаллов з кіслародам. Класіфікацыя аксідаў ўключае наступныя групы: кіслотныя, асноўныя, змяшчае амфотерные і абыякавыя. Галоўны крытэрый дзялення ўсіх гэтых рэчываў заключаецца ў тым, які элемент злучаецца з кіслародам. Калі гэта метал, то яны адносяцца да асноўных. Напрыклад: CuO, MgO, Na2O – вокісу медзі, магнію, натрыю. Іх асноўнае хімічнае ўласцівасць – гэта рэакцыя з кіслотамі. Так, аксід медзі рэагуе з хлоридной кіслатой:
CuO + 2HCl -> CuCl2 + H2O + 63, 3 кДж.
Прысутнасць атамаў неметалічных элементаў у малекулах бінарных злучэнняў сведчыць аб іх прыналежнасці да кіслотным аксідам, напрыклад, вокіс вадароду H2O, вуглякіслы газ CO2, пятиокись фосфару P2O5. Здольнасць такіх рэчываў рэагаваць са шчолачамі – галоўная іх хімічная характарыстыка.
У выніку рэакцыі могуць утварацца солі двух відаў: кіслыя або сярэднія. Гэта будзе залежаць ад таго, колькі моль шчолачы ўступае ў рэакцыю:
- CO2 + KOH => KHCO3;
- CO2+ 2KOH => K2CO3 + H2O.
Яшчэ адну групу кіслародзмяшчальных злучэнняў, у якія ўваходзяць такія хімічныя элементы, як цынк або алюміній, адносяць да амфотерным аксідам. У іх уласцівасцях прасочваецца тэндэнцыя да хімічнага ўзаемадзеяння як з кіслотамі, так і са шчолачамі. Прадуктамі ўзаемадзеяння кіслотных аксідаў з вадой з'яўляюцца кіслаты. Напрыклад, у рэакцыі сернага ангідрыду і вады ўтворыцца сульфатная кіслата. Кіслаты – гэта адзін з найбольш важных класаў кіслародзмяшчальных злучэнняў.
Больш:
Нервовы імпульс, яго пераўтварэнне і механізм перадачы
Нервовая сістэма чалавека выступае своеасаблівым каардынатарам у нашым арганізме. Яна перадае каманды ад мозгу мускулатуры, органаў, тканін і апрацоўвае сігналы, якія ідуць ад іх. У якасці своеасаблівага носьбіта дадзеных выкарыстоўваецца нервовы імп...
Куды паступаць пасля 11 класа? Якую выбраць прафесію?
Пры выбары сваёй будучай прафесіі не варта абапірацца на чые-то рэкамендацыі і парады, тым больш не трэба падпарадкоўвацца сваім бацькам, якія даволі часта вырашаюць без вас самастойна, куды паступіць пасля 11 класа. Варта задумацца, наколькі паспяхо...
Крывяносная сістэма жывёл, як вынік эвалюцыйнага развіцця свету
Крывяносная сістэма жывёл прайшла доўгі шлях фарміравання ў ходзе эвалюцыйнага развіцця свету. Яна ўтварылася на месцы рудыментарных частак першаснай паражніны цела, якая ў вышэйшых жывёл была выцесненая целломом, або другаснай паражніной цела. У пра...
Кіслоты і іх ўласцівасці
Злучэнні, якія складаюцца з вадародных атамаў, звязаных са складанымі іёнамі кіслотных рэшткаў – гэта кіслаты. Умоўна іх можна падзяліць на неарганічныя, напрыклад, карбонатную кіслату, сульфатную, нитратную, і арганічныя злучэнні. Да апошніх належаць воцатная кіслата, мурашыная, олеіновая кіслаты. Абедзве групы рэчываў маюць падобныя ўласцівасці. Так, яны ўступаюць у рэакцыю нейтралізацыі з падставамі, якія рэагуюць з солямі і асноўнымі аксідамі. Практычна ўсе кіслародзмяшчальныя кіслаты ў водных растворах дысацыюе на іёны, з'яўляючыся праваднікамі другога роду. Вызначыць кіслы характар іх асяроддзя, абумоўленай залішняй прысутнасцю вадародных іёнаў, можна з дапамогай індыкатараў. Напрыклад, фіялетавы лакмус пры даданні яго ў раствор кіслаты набывае чырвоную афарбоўку. Тыповым прадстаўніком арганічных злучэнняў з'яўляецца воцатная кіслата, якая змяшчае карбаксільныя групу. У яе ўваходзіць атам вадароду, які і абумоўлівае кіслотныя ўласцівасці рэчывы. Гэта бескаляровая вадкасць са спецыфічным рэзкім пахам, кристаллизующаяся пры тэмпературы ніжэй 17 °С. CH3COOH, як і іншыя кіслародзмяшчальныя кіслаты, выдатна раствараецца ў вадзе ў любых прапорцыях. Яе 3 – 5 % раствор вядомы ў побыце пад назвай воцату, які выкарыстоўваюць у кулінарыі як заправу. Рэчыва знайшло сваё прымяненне таксама ў вытворчасці ацетатного шоўку, фарбавальнікаў, пластычных мас і некаторых лекавых сродкаў.

Арганічныя злучэнні, якія змяшчаюць кісларод
У хіміі можна вылучыць вялікую групу рэчываў, якія змяшчаюць, акрамя вугляроду і вадароду, яшчэ і кіслародныя часціцы. Гэта карбонавыя кіслоты, эфіры, альдэгіды, спірты і фенолы. Усе іх хімічныя ўласцівасці вызначаюцца прысутнасцю ў малекулах асаблівых комплексаў – функцыянальных груп. Напрыклад, агульная хімічная формула спірту, які змяшчае толькі гранічныя сувязі паміж атамамі – ROH, дзе R – вуглевадародны радыкал. Гэтыя злучэння прынята разглядаць як вытворныя алканов, у якіх адзін вадародны атам замешчаны гидроксогруппой.
Фізічныя і хімічныя ўласцівасці спіртоў
Агрэгатны стан спіртоў – гэта вадкасці або цвёрдыя злучэння. Сярод спіртоў няма газападобных рэчываў, што можна растлумачыць адукацыяй ассоциатов – груп, якія складаюцца з некалькіх малекул, злучаных слабымі вадароднымі сувязямі. Гэтым фактам вызначаецца і добрая растваральнасць ніжэйшых спірту ў вадзе. Аднак у водных растворах кіслародзмяшчальныя арганічныя рэчывы – спірты, не дысацыюе на іёны, не змяняюць колер індыкатараў, то есць маюць нейтральную рэакцыю. Атам вадароду функцыянальнай групы слаба звязаны з іншымі часціцамі, таму ў хімічных узаемадзеяннях здольны пакідаць межы малекулы. Па месцы ж свабоднай валентнасці адбываецца яго замяшчэнне на іншыя атамы, напрыклад, у рэакцыях з актыўнымі металамі або са шчолачамі – на атамы металу. У прысутнасці каталізатараў, такіх, як плацінавая сетка або медзь, спірты акісляюцца энергічнымі акісляльнікамі – бихроматом або перманганатом калія, да альдэгідаў.

Рэакцыя этерификации
Адно з найважнейшых хімічных уласцівасцяў кіслародзмяшчальных арганічных рэчываў: спіртоў і кіслот – гэта рэакцыя, якая прыводзіць да атрымання складаных эфіраў. Яна мае вялікае практычнае значэнне і выкарыстоўваецца ў прамысловасці для здабывання эстеров, якія выкарыстоўваюцца ў якасці растваральнікаў, у харчовай прамысловасці (у выглядзе фруктовых эсэнцый). У медыцыне некаторыя з эфіраў ўжываюць у якасці спазмолитиков, напрыклад, этилнитрит пашырае перыферычныя крывяносныя пасудзіны, а изоамилнитрит з'яўляецца пратэктарам спазмаў каранарных артэрый. Раўнанне рэакцыі этерификации мае наступны выгляд:
CH3COOH+C2H5OH<--(H2SO4)-->CH3COOC2H5+H2O
У ёй CH3COOH – гэта воцатная кіслата, а C2H5OH – хімічная формула спірту этанолу.
Альдэгіды
Калі злучэнне змяшчае функцыянальную групу –COH, то яно адносіцца да альдегидам. Іх прадстаўляюць як прадукты далейшага акіслення спіртоў, напрыклад, такімі акісляльнікамі, як аксід медзі.

Прысутнасць карбанільных комплексу ў малекулах мурашынага або воцатнага альдэгіду абумоўліваюць іх здольнасць полимеризоваться і далучаць атамы іншых хімічных элементаў. Якаснымі рэакцыямі, з дапамогай якіх можна даказаць наяўнасць карбанільных групы і прыналежнасць рэчыва да альдегидам, з'яўляюцца рэакцыя срэбнага люстэрка і ўзаемадзеянне з гідравокісы медзі пры награванні:
Найбольшае ўжыванне атрымаў ацэтальдэгід, які выкарыстоўваецца ў прамысловасці для атрымання воцатнай кіслаты – шмат тоннажного прадукту арганічнага сінтэзу.
Уласцівасці кіслародзмяшчальных арганічных злучэнняў – карбонавых кіслот
Наяўнасць карбаксільныя групы – адной або некалькіх – гэта адметная рыса карбонавых кіслот. Дзякуючы будынку функцыянальнай групы, у растворах кіслот могуць утварацца дымеры. Яны звязаныя паміж сабой вадароднымі сувязямі. Злучэння дысацыюе на катыёны вадароду і аніёны кіслотнага астатку і з'яўляюцца слабымі электралітамі. Выключэннем служыць першы прадстаўнік шэрагу гранічных одноосновных кіслот – мурашыная, або метановая, якая з'яўляецца правадніком другога роду сярэдняй сілы. Прысутнасць у малекулах толькі простых сігма - сувязяў кажа аб гранічным, калі ж рэчывы маюць у сваім складзе падвойныя пі-сувязі – гэта непредельные рэчывы. Да першай групы ставяцца такія кіслаты, як метановая, воцатная, алейная. Другая прадстаўлена злучэннямі, якія ўваходзяць у склад вадкіх тлушчаў – алеяў, напрыклад, олеіновая кіслатой. Хімічныя ўласцівасці кіслародзмяшчальных злучэнняў: арганічных і неарганічных кіслот шмат у чым падобныя. Так, яны могуць ўзаемадзейнічаць з актыўнымі металамі, іх аксідамі, шчолачамі, а таксама са спіртамі. Напрыклад, воцатная кіслата рэагуе з натрыем, аксідам і з'едлівым натром з адукацыяй солі – ацэтату натрыю:
NaOH + CH3COOH→NaCH3COO + H2O
Асаблівае месца займаюць злучэння вышэйшых карбонавых кіслародзмяшчальных кіслот: стэарынавай і пальміціновая, з трехатомным гранічным спіртам – гліцэрынай. Яны ставяцца да складаным эфірам і называюцца тлушчамі. Гэтыя ж кіслаты ўваходзяць у склад соляў натрыю і калія ў якасці кіслотнага астатку, утвараючы мыла.

Тлушчы і мыла
Важныя арганічныя злучэнні, шырока распаўсюджаныя ў жывой прыродзе і гуляюць вядучую ролю ў якасці найбольш энергаёмістай рэчывы – гэта тлушчы. Яны ўяўляюць сабой не індывідуальнае злучэнне, а сумесь разнастайных глицеридов. Гэта злучэння гранічнага многоатомного спірту – гліцэрыны, які, як і метанол і фенол, змяшчае гідраксільная функцыянальныя групы. Тлушчы можна падвергнуць гідролізу – награвання з вадой у прысутнасці каталізатараў: шчолачаў, кіслот, аксідаў цынку, магнію. Прадуктамі рэакцыі будуць гліцэрына і розныя карбонавыя кіслоты, у далейшым выкарыстоўваюцца для вытворчасці мыла. Каб у гэтым працэсе не выкарыстоўваць дарагія прыродныя харчовыя тлушчы, неабходныя карбонавыя кіслаты атрымліваюць, окисляя парафін.

Фенолы
Заканчваючы разглядаць класы кіслародзмяшчальных злучэнняў, спынімся на фенолах. Яны прадстаўлены радыкалам фенилом -C6H5, злучаным з адной або некалькімі функцыянальнымі гідраксільная групамі. Найпросты прадстаўнік гэтага класа – карболовая кіслата, або фенол. Як вельмі слабая кіслата, ён можа ўзаемадзейнічаць са шчолачамі і актыўнымі металамі – натрыем, каліем. Рэчыва з ярка выяўленымі бактэрыцыднымі ўласцівасцямі - фенол ўжываецца ў медыцыне, а таксама пры вытворчасці фарбавальнікаў і фенолформальдегидных смол.

У нашай артыкуле мы вывучылі асноўныя класы кіслародзмяшчальных злучэнняў, а таксама разгледзелі іх хімічныя ўласцівасці.
Article in other languages:
HI: https://tostpost.com/hi/education/18342-oxygenated-compounds-examples-properties-equations.html
PT: https://tostpost.com/pt/educa-o/31738-oxigenados-de-conex-o-exemplos-propriedades-f-rmulas.html
UK: https://tostpost.com/uk/osv-ta/32476-kisnevm-sn-spoluki-prikladi-vlastivost-formuli.html
ZH: https://tostpost.com/zh/education/17271-oxygenated-compounds-examples-properties-equations.html

Alin Trodden - аўтар артыкула, рэдактар
"Прывітанне, Я Алін Тродден. Я пішу тэксты, чытаю кнігі і шукаю ўражанні. І я нядрэнна ўмею распавядаць вам пра гэта. Я заўсёды рады ўдзельнічаць у цікавых праектах."
Навіны
Дзе знаходзіцца Тайланд: геаграфічнае становішча і асаблівасці краіны
Тайланд, мабыць, - адно з самых прасунутых у турыстычным плане дзяржаў. Ну хто не чуў аб знакамітым тайскім масажы або боксе? Дзе знаходзіцца Тайланд на карце свету? Аб геаграфічным становішчы і асаблівасцях гэтай краіны чытайце д...
Майкл Империоли: фільмаграфія акцёра і факты з асабістага жыцця
За ўсю шматгадовую прафесійную дзейнасць Майкл Империоли зарэкамендаваў сябе як паспяховы акцёр, сцэнарыст і рэжысёр. Ён зняўся ў дзевяноста чатырох карцінах. Пераважна гэта былі фільмы ў драматычных, крымінальных і камедыйных жан...
План аналізу лірычнага верша для 7-11 класаў. Аналіз лірычнага верша Пушкіна
На ўроках літаратуры настаўнік нярэдка просіць хлопцаў скласці план аналізу лірычнага верша і напісаць, грунтуючыся на ім, падрабязны разбор пэўнага твора. Што ж рабіць у гэтым выпадку вучню? На якія ключавыя асаблівасці варта звя...
То бр перехожие - што гэта такое на самай справе?
то бр перехожие – што гэта такое? Дзіўную фразу мы сустракаем, як правіла, перачытваючы старажытнарускія быліны. Вось то бр прыходзяць да Іллі Муромцу, просидевшему на печы, шмат гадоў, і прапануюць яму «пітво медвяное...
Педагогіка як навука, якой належыць будучыня
Навукі бываюць розныя. Сярод іх асаблівае месца адводзіцца сёння педагогіцы, якая пасля веры ў Бога з'яўляецца той нішай, якая можа выратаваць свет ад маральнай гібелі, так як педагогіка як навука аб выхаванні, то есць ператварэнн...
Мяккі знак на канцы прыслоўяў пасля шыпячых: правіла прыклады
- Чаму сумуеш, царэўна? Чаму сумны погляд?І крыўлянні скамарохаў з-за чаго не весяляць?- Ах, прысніўся мне царэвіч, ён настолькі быў прыгожы,І са мной здарылася што-то: мне ужо замуж карціць.Такі размова мог бы адбыцца ў чароўным ...





















Заўвага (0)
Гэтая артыкул не мае каментароў, будзьце першым!