La segunda ley de la termodinámica: definición, significado, historia
Termodinámica como independiente de la sección de física de la ciencia surgió en la primera mitad del siglo XIX. Ha estallado la era de la máquina. La revolución industrial exigía estudiar y comprender los procesos relacionados con el funcionamiento de los motores térmicos. En los albores de la máquina de la era de los inventores solteras podían permitirse el lujo de utilizar sólo la intuición y la método de тыка». No era de orden público en el descubrimiento y la invención, a nadie, incluso en la cabeza no podía venir, que pueden ser útiles. Pero cuando el calor (y un poco más tarde y eléctricas) de la máquina de acero de la base de la producción, la situación cambió. Los científicos finalmente poco a poco acabó la confusión terminológica, que reinaba hasta mediados de siglo XIX, una vez que haya establecido que llamar a la energía, que a la fuerza, que es el impulso.
Que postula termodinámica
Empezamos con conocidos de la información. Clásica termodinámica se basa en varios principios (igualdad), administrados secuencialmente a lo largo del siglo XIX. Es decir, estas disposiciones no son доказуемыми en su seno. Fueron formulados como resultado de la agregación de los datos empíricos.
El Primer principio – esto es, la aplicación de la ley de conservación de la energía a la descripción del comportamiento macroscópico de los sistemas consisten de un gran número de partículas). De un vistazo se puede formular así: la reserva de la energía interna aislado de la termodinámica del sistema se mantiene siempre constante.
El Significado del segundo principio de la termodinámica, que consiste en determinar la dirección en la que fluyen los procesos en tales sistemas.
El Tercer principio permite determinar exactamente esta magnitud, como la entropía. La examinaremos con más detalle.
El Concepto de entropía
La Formulación del segundo principio de la termodinámica fue propuesta en el año 1850, rodolfo Клаузиусом: «no es Posible espontáneo transición de calor de menos caliente con un cuerpo más нагретому». Cuando este Клаузиус destacó el mérito de sadi carnot, en 1824, se estableció que el porcentaje de energía que puede ser transformada en trabajo térmica de la máquina, sólo depende de la diferencia de temperatura del calentador y refrigerador.
Más:
El general walter von Reichenau: su biografía, sus logros y la historia
El General mariscal de campo de la alemania nazi walter von Reichenau (Walter von Reichenau) se contaba entre los pocos altos oficiales del ejército de la wehrmacht, que apoyó activamente el nazismo. Durante la Segunda guerra mundial fue comandante d...
Trajes espaciales de los astronautas: de la asignación de la unidad. El primer traje espacial
Trajes espaciales de los astronautas – no es simplemente trajes de vuelo en órbita. El primero de ellos se remonta a principios del siglo veinte. Era la época de antes de los vuelos espaciales restaba casi medio siglo. Sin embargo, los científi...
Oriental de la plataforma europea: forma de alivio. Minerales oriental de la plataforma europea
La Mayor parte del territorio europeo de rusia, así como de algunos países de la cei se encuentra en la parte continental de un tramo de la corteza terrestre, que lleva el nombre oriental de la plataforma europea. La forma del relieve aquí es predomi...

A La hora de desarrollar el segundo principio de la termodinámica Клаузиус se introduce el concepto de entropía - medidas de la cantidad de energía que es irreversible entra en el formulario, alguno de trato en el trabajo. Клаузиус expresó a este valor, la fórmula dS = dQ/T, donde dS, el cual determina el cambio de la entropía. Aquí:
DQ - el cambio de calor;
T – la temperatura absoluta (la misma que se mide en kelvin).
Un ejemplo Sencillo: потрогайте el capó de su coche cuando el motor. Claramente está más caliente del medio ambiente. Pero ya que el motor del vehículo no está diseñado para calentar el capó o el agua en el radiador. Convirtiendo la energía química de la gasolina en calor, y luego en la mecánica, que realiza un trabajo útil – hace girar el eje. Pero la mayor parte del calor se pierde, así como útil de trabajo de extraer de él no se puede, sino lo que sale del tubo de escape, ya que de ninguna manera la gasolina no es. Al hacerlo, la energía térmica se pierde, pero no desaparece, sino que se dispersa (диссипирует). Caliente el capó, por supuesto, se enfría, y cada ciclo de cilindros en el motor de nuevo le agrega calidez. Por lo tanto, el sistema trata de lograr el equilibrio térmico.
Características de la entropía
Клаузиус sacó un principio general para el segundo principio de la termodinámica en la fórmula de la dS ≥ 0. Sentido físico puede definirse como "неубывание" entropía: en negociadas en los procesos de lo que no cambia, en irreversibles - en aumento.
Hay que señalar que todos los procesos reales son irreversibles. El término неубывание» refleja el hecho de que en la consideración del fenómeno de encendido también es teóricamente posible ideales opción. Es decir, la cantidad disponible de energía en cualquier rodando el proceso aumenta.
La Posibilidad de alcanzar el cero absoluto
Max planck hizo importantes contribuciones al desarrollo de la termodinámica. Además del trabajo sobre estadísticas de la interpretación del segundo principio, se tomó una participación activa en постулировании el tercer principio de la termodinámica. El primero pertenece a Нернсту y se refiere a 1906. El teorema de Нернста examina la conducta de equilibrio del sistema con la temperatura, que favorece el cero absoluto. El primer y segundo principio de la termodinámica no dan la posibilidad de averiguar cuál será la entropía en estas condiciones.

Cuando T = 0 K, la energía es igual a cero, la partícula del sistema dejan de caótica térmicas de movimiento y forman ordenado de la estructura de cristal con la termodinámica probabilidad igual a la unidad. Entonces, la entropía también se dirige a cero (por debajo de la que nos enteramos de por qué sucede esto). En realidad, incluso se hace un poco antes de lo de lo que se deduce que la refrigeración de cualquier sistema termodinámico, a cualquier cuerpo hasta el cero absoluto es imposible. La temperatura se que lo desee acercarse a ese punto, pero no alcanza.
Perpetuum el móvil-el mvil: no, incluso si realmente quieres
Клаузиус ha generalizado y se hizo el primer y segundo principio de la termodinámica, por lo tanto: total de energía de cualquier sistema cerrado permanece siempre constante, mientras el total de la entropía aumenta con el tiempo.
La Primera parte de esta afirmación, impone la prohibición de movimiento perpetuo de primera clase – un dispositivo que cometa el trabajo sin flujo de energía de una fuente externa. La segundaparte prohibirá y de movimiento perpetuo de segunda clase. Esta máquina interpretó sería la energía de un sistema en funcionamiento sin энтропийной de la indemnización, sin violar la ley de conservación. Se podría bombear el calor de equilibrio de un sistema, por ejemplo, freír la tortilla o la colada de acero a expensas de la energía del movimiento térmico de las moléculas de agua de enfriamiento al este.
El Segundo y el tercer principio de la termodinámica prohíben el movimiento perpetuo de segunda clase.
Por Desgracia, la naturaleza nada se puede obtener no sólo un don, representa otro y a la comisión a pagar.
Térmica muerte»
Pocas en la ciencia de los conceptos, que causaron tanto ambiguos de las emociones, no sólo entre el público en general, sino también en el entorno de los propios científicos, cuánto correspondió a la entropía. De la física, y en primer lugar el Клаузиус, casi de inmediato экстраполировали la ley неубывания primero en la Tierra y, a continuación, y en todo el Universo (y por qué no, ya que de ella también se puede considerar termodinámico del sistema). Finalmente, la cantidad física de un elemento importante de los cálculos en muchas aplicaciones técnicas, se ha reconocido como la encarnación de la especie del Mal universal, уничтожающего ligero y amable del mundo.
En el entorno de los científicos que hay otros puntos de vista: ya que, de acuerdo a la segunda ley de la termodinámica, la entropía crece de forma irreversible, tarde o temprano, toda la energía del Universo se convierte en рассеянную forma, y llegará el «térmica muerte». ¿Qué hay que alegrarse? Клаузиус, por ejemplo, hace unos años no se atrevió a publicar sus conclusiones. Por supuesto, la hipótesis de la el calor de la muerte» inmediatamente provocó muchas objeciones. Serias dudas sobre su exactitud hay ahora.
El Demonio-clasificador
En 1867 james maxwell, uno de los autores molecular de la teoría cinética de los gases, en muy visual (aunque ficticia) el experimento demostró la aparente paradoja que el segundo principio de la termodinámica. Brevemente, la experiencia se puede resumir de la siguiente manera.
Supongamos Que se tiene un recipiente con gas. Las moléculas en él se mueven muy irregular, de la velocidad de un poco diferentes, pero la energía cinética media es la misma en todo el recipiente. Ahora dividiremos el vaso de un tabique en dos partes aisladas. La velocidad media de las moléculas en las dos mitades del recipiente seguirá siendo la misma. El tabique dogging un diminuto demonio, que permite más rápido, caliente» las moléculas de penetrar en una parte y la más lenta frío» en la otra. En consecuencia, en la primera mitad de gas caliente, en la segunda – se enfría, es decir, de un estado de equilibrio térmico, el sistema pasará a la diferencia de temperatura de capacidades, lo que significa una disminución de la entropía.
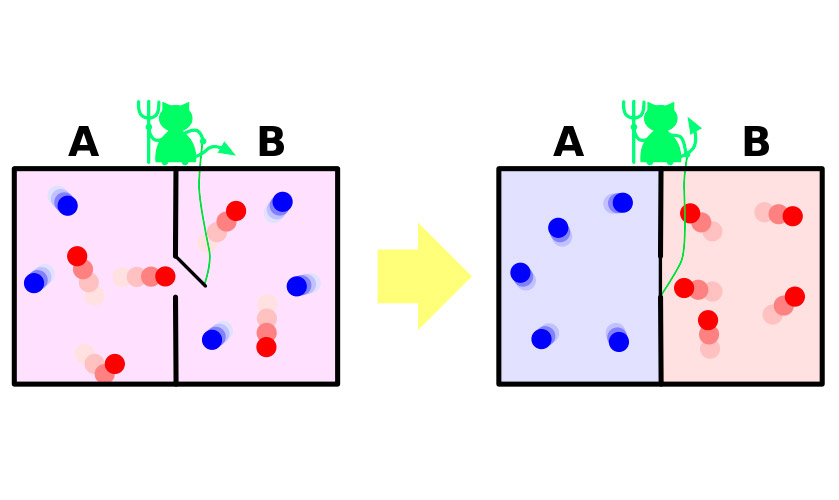
El problema radica en que en el experimento, el sistema realiza esta transición no de manera espontánea. Ella recibe la energía desde el exterior, a través de la cual se abre y se cierra con cerrojo, o bien el sistema con la necesidad de incluye el demonio, затрачивающего su energía en el cumplimiento del deber del píloro. El aumento de entropía de un demonio con un exceso cubrirá la disminución en la franja de gaza.
Indisciplinados de la molécula
Tome un vaso con agua y la dejamos en la mesa. Observar el vaso no es necesariamente suficiente después de un tiempo, volver atrás y comprobar el estado del agua en el mismo. Veremos que su número ha disminuido. Si dejar el vaso por mucho tiempo, no se detecta agua, ya que toda ella se evapore. En el comienzo de un proceso, las moléculas de agua se encontraban en una dificultad las paredes de los vasos de las regiones del espacio. Al final del experimento se han difundido por toda la habitación. En el volumen de una habitación cerca de las moléculas de mucha más capacidad de cambiar su ubicación sin ningún tipo de consecuencias para el estado del sistema. Nosotros no podemos recogerlos en el soldadas "equipo" y hacer entrar de nuevo en el vaso, para con beneficios para la salud de beber agua.

Esto significa que el sistema ha evolucionado a un estado más alto que el de la entropía. Según el segundo principio de la termodinámica, la entropía, o el proceso de dispersión de las partículas de un sistema (en este caso, las moléculas de agua) es irreversible. ¿Por qué es esto así?
Клаузиус no respondió a esta pregunta, sí y nadie más pudo hacerlo antes de ludwig boltzmann.
Macro y микросостояния
En 1872, este científico introdujo en la ciencia de la estadística de la interpretación del segundo principio de la termodinámica. Ya que macroscópicos del sistema, con los que se ocupa la termodinámica, están formadas por una gran cantidad de elementos, cuyo comportamiento obedece a las leyes de la estadística.
De Vuelta a las moléculas de agua. Es muy irregular volando por la habitación, pueden ocupar diferentes posiciones, tener algunas diferencias en las velocidades (las moléculas se encuentran constantemente entre sí y con otras partículas en el aire). Cada opción de estado de un sistema de moléculas se llama микросостоянием, y de tales opciones de una cantidad enorme. Cuando la aplicación de la inmensa mayoría de las opciones de макросостояние el sistema no cambia de ningún modo.
Nada prohibido, pero hay algo que es muy improbable
El Famoso relación S = k lnW vincula el número de formas posibles que puede expresar una cierta макросостояние termodinámico del sistema (W), con su entropía S. el Valor de W se llama termodinámica probabilidad. El aspecto final de esta fórmula ha dado a la Max planck.El coeficiente k – es una pequeña cantidad (1,38×10−23 j/A), describir la relación entre la energía y la temperatura, planck llamó la constante de boltzmann en honor del científico, que fue el primero que propuso la dirección de estadística de la interpretación del segundo principio de la termodinámica.

Claro que W – siempre un número natural 1, 2, 3,…N (no hay un número de formas. Entonces el logaritmo de W, y, por consiguiente, la entropía, no pueden ser negativos. Cuando la única posible para el sistema de микросостоянии la entropía se hace igual a cero. Volviendo a nuestro vaso, este postulado se puede representar como: las moléculas de agua, al azar corriendo de la habitación, de vuelta de nuevo en el vaso. Cada uno en la precisión reiteró su camino y terminó en el vaso el mismo lugar en que estaba antes de la salida. Nada impide que la implementación de esta opción, en la que la entropía es cero. Sólo esperar a que el ejercicio de dicha исчезающе pequeña probabilidad de que no vale la pena. Este es uno de los ejemplos de lo que se puede realizar sólo en teoría.
Todos mezclados en la casa…
Por lo tanto, la molécula es muy irregular vuelan por la habitación de diferentes maneras. No hay ninguna ley en su ubicación, no hay orden en el sistema, como ni cambiar las opciones de микросостояний, no establece ningún внятной de la estructura. En el vaso fue el mismo, pero debido a las limitaciones de espacio de las moléculas de cambiaban su posición no es tan activa.
Caótico, неупорядоченное el estado del sistema como el más probable corresponde a la máxima entropía. El agua en el vaso es un ejemplo más de низкоэнтропийного de estado. La transición a él desde distribuidos por la sala del caos prácticamente inviable.
Veamos más claro para todos nosotros un ejemplo - limpieza de desorden en la casa. Para poner todo en su lugar, a nosotros también nos tienen que gastar energía. En el proceso de esta obra, se convierte en caliente (es decir, nosotros no мерзнем). Resulta que la entropía puede beneficiar. Esto es lo que hay. Se puede decir incluso más: la entropía, y a través de ella la segunda ley de la termodinámica (junto con la energía) que controlan el Universo. Veamos, una vez más en procesos reversibles. Así se ve el mundo, no ya de la entropía: hay desarrollo, ninguna de las galaxias, las estrellas, los planetas. Ninguna vida...
Todavía un poco de información acerca de la el calor de la muerte». Hay buenas noticias. Dado que, según la teoría estadística, la prohibidas» los procesos son, en realidad, improbables, en termodinámicamente en equilibrio el sistema se producen fluctuaciones – espontáneos de la violación del segundo principio de la termodinámica. Pueden ser arbitrariamente grandes. Cuando se enciende la gravedad en el sistema termodinámico la distribución de las partículas ya no se es muy irregular-uniforme, y el estado de máxima entropía no se alcanza. Además, el universo no es inmutable, permanente, fijo. Por lo tanto, el planteamiento mismo de la pregunta acerca de la el calor de la muerte» carece de sentido.
Article in other languages:
KK: https://tostpost.com/kk/b-l-m/2269-termodinamikany-ek-nsh-bastamasy-any-tamasy-m-n-tarihy.html
TR: https://tostpost.com/tr/e-itim/2274-kinci-ba-lang-termodinami-in-tan-m-anlam-tarih-esi.html
UK: https://tostpost.com/uk/osv-ta/2271-druge-pochatok-termodinam-ki-viznachennya-zm-st-stor-ya.html

Alin Trodden - autor del artículo, editor
"Hola, soy Alin Trodden. Escribo textos, leo libros y busco impresiones. Y no soy mala para decírtelo. Siempre estoy feliz de participar en proyectos interesantes."
Noticias Relacionadas Con La
La escuela de las relaciones humanas como una nueva forma de gobernanza en la gestión de
A comienzos de la década del 30 del siglo XX en Occidente comenzaron a formarse las primeras condiciones para la creación de una nueva escuela de las relaciones humanas, que ha complementado sería el desarrollo de la clásica y cie...
Colonias inglesas en américa del norte. El país - las antiguas colonias del reino unido
Hay un gran número de leyendas y diferentes según el grado de veracidad de los relatos de los valientes marineros, mucho antes de colón han visitado en américa del norte. Entre ellos se encontraban los monjes chinos, aproximadamen...
¿Qué es el ojo? ¿Cuál es la función de los ojos en el cuerpo humano?
la Capacidad de recibir información sobre el mundo por medio de la vista – es realmente útil y la capacidad de la persona. Nos memorizamos muy imagen de lo que está sucediendo, como si la foto. El ojo es el «el aparato...
¿Qué es el lenguaje? El problema de malas palabras
Habituales charlas formulaciones pueden ser inaceptables, simplemente la gente sobre esto rara vez reflexionan. Como resultado de los adultos es de extrañar, donde los niños aprenden a «malas palabras» ¿y por qué se en...
El mundo es todo lo que nos rodea
En este artículo se proporciona el material para los alumnos de 3er grado, el mundo que nos rodea para que se proporciona en la forma de modelos simplificados de los ecosistemas. También examinaron el concepto de sociedad de perso...
Hándicap - ¿qué es esto? Europeo y asiático
a Pesar de que el idioma ruso es uno de los más ricos en el mundo, por su vocabulario, tiene muchas raíces de las palabras. Ya que cada lengua no es sólo un conjunto específico de las unidades léxicas, sino siempre un organismo, s...






















Comentarios (0)
Este artículo no tiene comentarios, se el primero!