Halógenos: propiedades físicas, propiedades químicas. El uso de halógenos y sus compuestos
Halógenos en la tabla periódica se encuentran a la izquierda de gases nobles. Estos cinco tóxicos de elementos no metálicos entran en el grupo 7 de la tabla periódica. A ellos se refieren flúor, cloro, bromo, yodo y ástato. Aunque po radiactivo y tiene sólo isótopos de período corto, se comporta como el yodo, y a menudo consideran a галогенам. Porque halógena elementos tienen siete electrones de valencia, necesitan sólo un electrón para la educación completa de un octeto. Esta característica los hace más activos que otros grupos no metales.
Descripción
Halógenos forman двухатомные de la molécula (tipo X2, donde X representa un átomo de halógeno) – la forma estable de la existencia de los halógenos en la forma de las entradas. Estas двухатомных moléculas son неполярными, ковалентными y únicos. Propiedades químicas de los halógenos les permiten fácilmente entrar en conexión con la mayoría de los elementos, por lo que nunca se encuentran en la несвязанном como en la naturaleza. El flúor – el más activo de halogeno, y po – los menos.
Todos los halógenos forman una sal I grupo con similares propiedades. En estas conexiones halógenos presentes en forma de halogenuros de aniones con carga -1 (por ejemplo, Cl-, Br-). La terminación-id indica la presencia de un haluro de-aniones; por ejemplo, Cl- se llama cloruro».
Además, las propiedades químicas de los halógenos les permiten actuar como agentes oxidantes – oxidar metales. La mayoría de las reacciones químicas en las que participan halógenos – redox en disolución. Halógenos forman simples relación con el carbono o el nitrógeno orgánico en las conexiones que el grado de oxidación (CO) es igual a -1. Cuando un átomo de halógeno sustituido ковалентно-relacionadas por un átomo de hidrógeno en la conexión, el prefijo de halo puede ser utilizado en un sentido general, o los prefijos de flúor, cloro, el bromo , el yodo- – para determinados libre de halógenos. Halógena elementos pueden tener una relación con la educación двухатомных moléculas polares con ковалентными una sola de las relaciones.
Más:
El general walter von Reichenau: su biografía, sus logros y la historia
El General mariscal de campo de la alemania nazi walter von Reichenau (Walter von Reichenau) se contaba entre los pocos altos oficiales del ejército de la wehrmacht, que apoyó activamente el nazismo. Durante la Segunda guerra mundial fue comandante d...
Trajes espaciales de los astronautas: de la asignación de la unidad. El primer traje espacial
Trajes espaciales de los astronautas – no es simplemente trajes de vuelo en órbita. El primero de ellos se remonta a principios del siglo veinte. Era la época de antes de los vuelos espaciales restaba casi medio siglo. Sin embargo, los científi...
Oriental de la plataforma europea: forma de alivio. Minerales oriental de la plataforma europea
La Mayor parte del territorio europeo de rusia, así como de algunos países de la cei se encuentra en la parte continental de un tramo de la corteza terrestre, que lleva el nombre oriental de la plataforma europea. La forma del relieve aquí es predomi...
El Cloro (Cl2) se convirtió en el primer halógenos, abierto en el año 1774, a continuación, se abrieron yodo (I2), el bromo (Br2), flúor (F2) y po (At, detectado por último, en 1940). Nombre de la halógenos» se deriva de raíces griegas hal - sal») y -gen formar»). En conjunto, estas palabras significan солеобразующий», destacando el hecho de que halógenos, al entrar en reacción con los metales, forman la sal. La halita – es el nombre de la sal de roca, mineral natural, compuesto de cloruro de sodio (NaCl). Y, por último, halógenos se utilizan en el hogar – el fluoruro figura en la pasta de dientes, el cloro desinfecta el agua potable y el yodo contribuye a la formulación de las hormonas de la tiroides.
Químicas
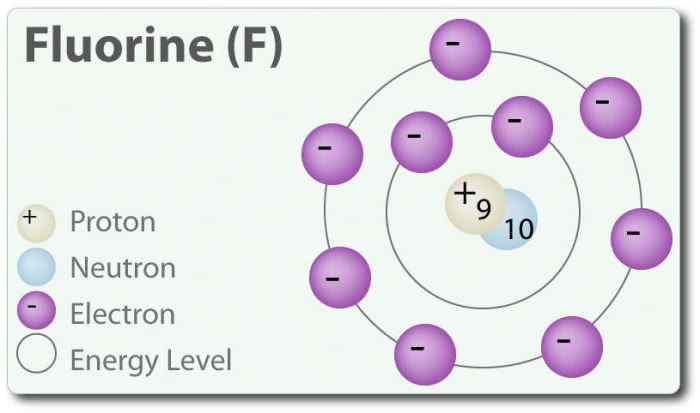
Flúor – el elemento de número atómico 9, se indica mediante un símbolo de la F. flúor Elemental, por primera vez, fue descubierto en 1886, mediante la asignación de ácido fluorhídrico. En el estado libre de flúor existe en la forma de двухатомной de la molécula (F2) y es el más común de halógenos en la corteza terrestre. El flúor – la mayoría de los электроотрицательный elemento en la tabla periódica. Cuando la temperatura ambiente es amarillo pálido gas. El flúor también es relativamente pequeño el radio atómico. Su CON – -1, excepto elemental двухатомного estado en el que su grado de oxidación es igual a cero. El flúor químicamente muy activo e interactúa directamente con todos los elementos, excepto el helio (He), neón (Ne) y argón (Ar). En una solución de H2O, el ácido fluorhídrico (HF) es un ácido débil. Aunque el flúor muy электроотрицателен, su электроотрицательность no determina la acidez; HF es un ácido débil en relación con el hecho de que el ion fluoruro básico (ph> 7). Además, el flúor produce muy potentes oxidantes. Por ejemplo, el flúor puede reaccionar con el gas inerte xenn y constituye un agente oxidante fuerte дифторид de xenón (XeF2). El flúor multitud de aplicaciones.
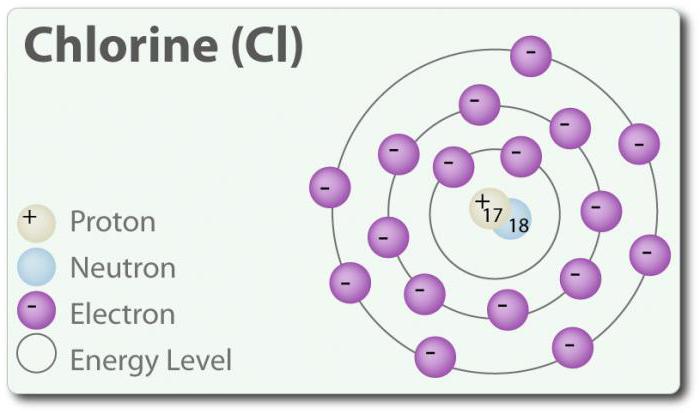
El Cloro – el elemento de número atómico 17 y el símbolo químico Cl. Descubierto en 1774 el año a través de la asignación de ácido clorhídrico. En su estado elemental que forma двухатомную molécula Cl2. El cloro tiene varios CON: -1, +1, 3, 5 y 7. A temperatura ambiente es el verde claro de gas. Así como la relación que se forma entre dos átomos de cloro, es débil, la molécula de la Cl2 tiene una muy alta capacidad de entrar en conexión. El cloro reacciona con los metales con la formación de sales que se llaman cloruros. Los iones de cloro son los más comunes iones se encuentran en el agua de mar. El cloro también tiene dos isótopos: 35Cl y 37Cl. El cloruro de sodio es el más común de conexión de todos los cloruros.
El Bromo – un elemento químico de número atómico 35 y un símbolo de la Br. La primera vez que fue descubierto en 1826, En su forma elemental el bromo es двухатомной molécula Br2. A temperatura ambiente es un color rojizo-marrón líquido. Su CON – -1, + 1, 3, 4 y 5. El bromo es más activo que el yodo, pero menos activo que el cloro. Además, el bromo tiene dos isótopos: 79Vg y 81Vg. El bromo se encuentra en forma de sales de bromuro, disueltos en el agua de mar. En los últimos años la producción de bromuro en el mundo ha aumentado considerablemente, gracias a su disponibilidad y duradero en el tiempo de la vida. Al igual que otros halógenos, bromoes окислителем y muy tóxico.
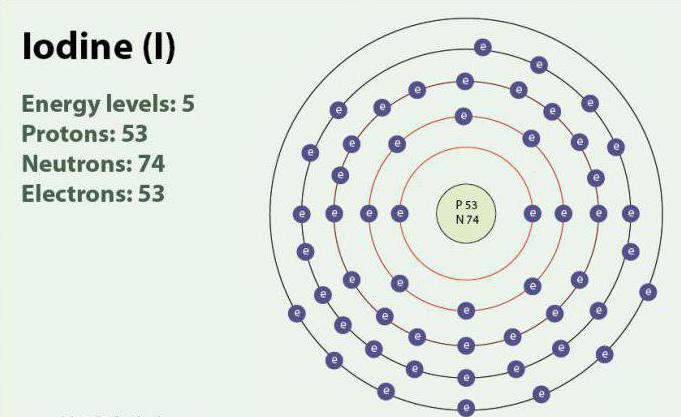
El Yodo – un elemento químico de número atómico 53 y un símbolo de la I. Yodo posee el grado de oxidación: -1, +1, +5 y +7. Existe en la forma de двухатомной de la molécula, I2. A temperatura ambiente es una sustancia sólida de color púrpura. El yodo es un isótopo estable - 127I. descubierto por Primera vez en el año 1811 con la ayuda de algas marinas y de ácido sulfúrico. En la actualidad, los iones de yodo, pueden ser resaltados en el agua de mar. A pesar de que el yodo no es muy bueno, soluble en agua, su solubilidad puede aumentar cuando el uso de cada uno йодидов. El yodo juega un papel importante en el organismo, participando en la elaboración de las hormonas de la tiroides.
Po – el elemento radiactivo de número atómico de un 85 y un símbolo de la At. Sus posibles grado de oxidación: -1, +1, 3, 5 y 7. La única halógenos, no es двухатомной molécula. En condiciones normales es de metal de una sustancia sólida de color negro. Po es muy raro elemento, por lo tanto, poco se sabe de él. Además, el po tiene un muy corto período de semidesintegración, no más de un par de horas. Obtuvo en 1940, como resultado de la síntesis. Creen que el po es similar al yodo. Es diferente de metal de propiedades.
En la tabla siguiente se muestra la estructura de los átomos de los halógenos, la estructura de la capa externa de electrones.
Halo | Configuración de electrones |
Flúor | 1s2 22 2p5 |
El Cloro | 3s2 3p5 |
El Bromo | 3d10 4s2 4p5 |
El Yodo | 4d10 5s2 5p5 |
Po | 4f14 5d10 6s2 6p5 |
Similar a la estructura de la capa externa de electrones hace que las propiedades físicas y químicas de halógenos son similares. Sin embargo, cuando se comparan estos elementos se observan diferencias.
Periódicas de las propiedades en el grupo de los halógenos
Las propiedades Físicas de las sustancias simples de halógenos cambian con el aumento del número ordinal de un elemento. Para una mejor absorción y mayor visibilidad le ofrecemos varias tablas.
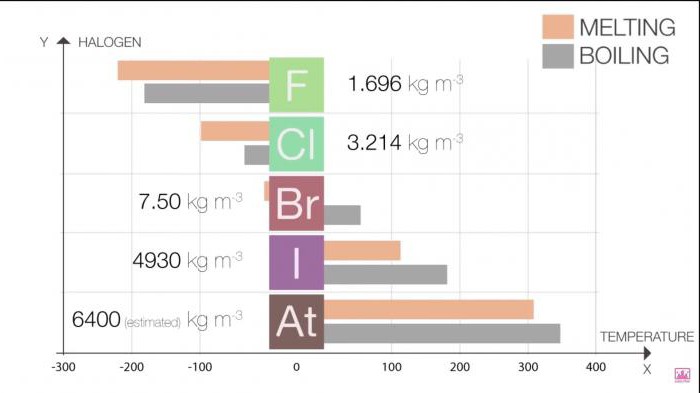
El Punto de fusión y punto de ebullición en el grupo aumentan el tamaño de las moléculas (F <Cl <Br <I <At). Este aumento significa un aumento del poder de fuerzas de van der waals.
En la tabla 1. Halógenos. Propiedades físicas: punto de fusión y punto de ebullición
Halo | T de fusión (C) | T de ebullición (C) |
Flúor | -220 | -188 |
El Cloro | -101 | -35 |
El Bromo | -7.2 | 58.8 |
El Yodo | 114 | 184 |
Po | 302 | 337 |
- El radio Atómico aumenta.
El Tamaño del núcleo aumenta (F < Cl < Br < I < At), ya que aumenta el número de protones y de neutrones. Además, a cada período se agrega cada vez más los niveles de energía. Esto lleva a una mayor орбитали, y, por lo tanto, a aumentar el radio de un átomo.
La tabla 2. Halógenos. Propiedades físicas: las radios
Halo | Radio iónico (pm) | Iones de Litio (X-) radio (pm) |
Flúor | 71 | 133 |
El Cloro | 99 | 181 |
El Bromo | 114 | 196 |
El Yodo | 133 | 220 |
Po | 150 |
- Energía de ionización disminuye.
Si exteriores de los electrones de valencia no están cerca del núcleo, para su eliminación no tendrá mucha energía. Por lo tanto, la energía necesaria para expulsar externo del electrón no es tan alta en la parte inferior de un grupo de elementos, ya que aquí más que sus niveles de energía. Además, la alta energía de ionización hace que un elemento de manifestar no metálicos de calidad. El yodo y la exhibición de la po manifiestan de metal de la propiedad, ya que la energía de ionización disminuye (At < I < Br < Cl < F).
En la tabla 3. Halógenos. Propiedades físicas: energía de ionización
Halo | Energía de ionización (kj/mol) |
Flúor | 1681 |
El cloro | 1251 |
El bromo | 1140 |
El yodo | 1008 |
Po | 890±40 |
- Электроотрицательность disminuye.
El Número de electrones de valencia de un átomo aumenta con el aumento de los niveles de energía cuando progresivamente niveles más bajos. Los electrones progresivamente más lejos del núcleo; Por lo tanto, el núcleo y los electrones no se como se atraenel uno al otro. El aumento de blindaje se observa. Por lo tanto, Электроотрицательность disminuye con el aumento del período de tiempo (At < I < Br < Cl < F).
La tabla 4. Halógenos. Propiedades físicas: электроотрицательность
Halo | Электроотрицательность |
El flúor | 4.0 |
El cloro | 3.0 |
El bromo | 2.8 |
El yodo | 2.5 |
Po | 2.2 |
- Afinidad a электрону disminuye.
Así como el tamaño de un átomo aumenta con el aumento del período de afinidad a электрону, como regla general, se reduce (En < I < Br < F < Cl). Excepción – el flúor, la afinidad de la cual es menor que el del cloro. Esto puede explicarse por el menor tamaño de flúor en comparación con el cloro.
En la tabla 5. La afinidad de halógenos a электрону
Halo | Afinidad a электрону (kj/mol) |
Flúor | -328.0 |
El cloro | -349.0 |
El bromo | -324.6 |
El yodo | -295.2 |
Po | -270.1 |
- La Reactividad de los elementos disminuye.
Reactividad de halógenos cae con el aumento del período de tiempo (At <I <Br <Cl <F). Esto está relacionado con el aumento del radio de un átomo con el incremento de los niveles de energía de los electrones. Esto reduce la atracción de los electrones de valencia de otros átomos, reduciendo la reactividad. Esta reducción también se produce debido a la caída de электроотрицательности con el aumento en el período, lo que también reduce la atracción de los electrones. Además, con el aumento de tamaño de un átomo se reduce y la capacidad oxidativa.
Química Inorgánica. Hidrógeno + halógenos
Haluro se forma cuando reacciona con halógenos otros, menos электроотрицательным elemento con la formación de un binario de la conexión. El hidrógeno reacciona con halógenos, formando haluros tipo de НХ:
- Fluoruro de hidrógeno HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводород HI.
Haluros de hidrógeno se disuelven fácilmente en el agua con la educación галогенводородной (fluorhídrico, la sal, бромистоводородной, иодистоводородной) de ácido. Las propiedades de estos ácidos se muestran a continuación.
Los Ácidos se forman de la siguiente reacción: HX (aq) + H2O (l) → X- (aq) + H3O+ (aq).
Todos los галоидоводороды forman ácidos fuertes, excepto HF.
La Acidez галогеноводородных ácidos aumenta: HF <HCl <HBr <HI.
El ácido hidrofluórico es capaz de grabar el vidrio y algunos fluoruros inorgánicos durante mucho tiempo.
Puede parecer contrario a la intuición, que HF es el más débil галогенводородной ácido, ya que el flúor tiene mayor электроотрицательностью. No obstante, la conexión de la N-F es muy fuerte y, en consecuencia, un ácido muy débil. La fuerte relación se basa en el borde corto de la longitud del enlace y la gran energía de disociación. De todos los haluros de hidrógeno HF tiene la más corta longitud de la comunicación y de la mayor energía de disociación de la relación.
Halógena оксокислоты
Halógena оксокислоты son ácidos, con átomos de hidrógeno, oxígeno y halógenos. Su acidez puede determinar mediante el análisis de la estructura. Halógena оксокислоты a continuación:
- Хлорноватистая ácido HOCl.
- Хлористая HClO ácido2.
- Хлорноватая HClO ácido3.
- ácido Perclórico HClO4.
- Бромноватистая ácido HOBr.
- Бромноватая ácido HBrO3.
- Бромная ácido HBrO4.
- Иодноватистая ácido HOI.
- Йодноватая ácido HIO3.
- Метайодная ácido HIO4, H5IO6.
En cada uno de estos ácidos protón está relacionado con el átomo de oxígeno, por lo que la comparación de las longitudes de los vínculos de los protones aquí es inútil. Aquí desempeña un papel dominante электроотрицательность. La actividad de los ácidos aumenta con el número de átomos de oxígeno asociado con el átomo central.
Apariencia y el estado de la sustancia
Las Principales propiedades físicas de halógenos brevemente se puede expresar en la siguiente tabla.
Estado de la materia (a temperatura ambiente) | Halo | Presentación |
Sólido | El yodo | Violeta |
Po | Negro | |
Líquido | El bromo | Rojo-marrón |
Gas | Flúor | Pálido, de color amarillo-marrón |
El cloro | Verde pálido |
La Explicación de la apariencia
El Color de los halógenos es el resultado de la absorción de la luz visible de las moléculas, lo que provoca la excitación de los electrones. El flúor absorbe la luz violeta, y, por lo tanto, se ve un color amarillo. El yodo, por el contrario, absorbe la luz amarilla y se ve violeta amarillo y morado – como complemento de color). El color de los halógenos cada vez más con el aumento del período.
En recipientes cerrados líquido el bromo y el yodo sólido está en equilibrio con sus pares, que se pueden observar en una especie de gas.
Aunque el color de астата desconocido, se supone que debe ser más oscuro que la carencia de yodo (es decir, en negro) en conformidad a la ley.
Ahora, si se te pide que: «comparar y contrastar las propiedades físicas de los halógenos», usted será más que decir.
El Grado de oxidación de los halógenos en las conexiones
El Grado de oxidación se utiliza a menudo en lugar de la noción de "valencia de halógenos". Como regla general, el grado de oxidación es igual a -1. Pero si halógenos está asociado con el oxígeno u otros halógenos, también puede tomar otras de estado: CON oxígeno -2 tiene prioridad. En el caso de los dos tipos de átomos de halógeno, los estados juntos, más электроотрицательный átomos solicitud de cuenta conjunta y recibe CON -1.
Por Ejemplo, el cloruro de yodo (ICl) el cloro es DE -1, y el yodo +1. El cloro es más электроотрицательным que el yodo, por lo que su CON es igual a -1.
En бромной ácido (HBrO4) el oxígeno tiene CON -8 (-2 x 4 átomo = -8). El hidrógeno tiene un grado de oxidación de +1. La suma de estos valores, se obtiene CON -7. Así como el final DE la conexión debe ser cero, CON el bromo es igual a +7.
La Tercera excepción a la regla es el grado de oxidación de los halógenos en su forma elemental (X2), donde él es igual a cero.
Halo | CON conexiones |
El flúor | -1 |
El cloro | -1, +1, +3, +5, +7 |
El bromo | -1, +1, +3, +4, +5 |
El yodo | -1, +1, +5, +7 |
Po | -1, +1, +3, +5, +7 |
¿por Qué CON flúor siempre -1?
Электроотрицательность aumenta con el crecimiento del período. Por lo tanto, el flúor tiene la más alta электроотрицательность de todos los elementos, lo que confirma su posición en la tabla periódica. Su configuración electrónica 1s2 22 2p5. Si el flúor tiene un electrón, las r-орбитали totalmente llenos y constituyen la totalidad del octeto. Debido a que el flúor tiene una alta электроотрицательность, se puede fácilmente quitar el electrón de un átomo vecino. El flúor en este caso, изоэлектронен инертному gas (con ocho валентными electrones), todas exteriores орбитали llena. En este estado, el flúor es mucho más estable.
Obtención y aplicación de halógenos
En la naturaleza halógenos se encuentran en un estado de aniones, por lo tanto, libres de halógenos se obtiene por la oxidación mediante la electrólisis o con la ayuda de agentes oxidantes. Por ejemplo, el cloro se produce гидролизом de la solución de sal común. El uso de halógenos y sus compuestos diversa de la tierra.
- Flúor. A pesar de que el flúor es muy реактивен, que se utiliza en muchas áreas de la industria. Por ejemplo, él es la clave de los componentes de ptfe (teflón), y algunos otros fluoropolímero. Los clorofluorocarbonos son sustancias químicas orgánicas que fueron utilizadas como refrigerantes y пропеллентов en los aerosoles. Su aplicación ha cesado debido a la posibilidad de su impacto en el medio ambiente. Fueron reemplazados por los hidroclorofluorocarbonos. El flúor se añaden a la pasta de dientes (SnF2) y agua potable (NaF) para la prevención de la caries dental. Este halo figura en la arcilla utilizada para la producción de algunos tipos de cerámica (LiF), se utiliza la energía nuclear (UF6), para obtener un antibiótico фторхинолона, de aluminio (Na3Pedro6), para el aislamiento de los equipos de alta tensión (SF6).
- El Cloro también encontró polivalente. Se utiliza para la desinfección de agua potable y piscinas. El hipoclorito de sodio (NaClO) es el principal componente abrillantadores. El ácido clorhídrico se utiliza ampliamente en la industria y en los laboratorios. El cloro está presente en поливинилхлориде (pvc) y otros polímeros que se utilizan para el aislamiento del cableado, tubería y de la electrónica. Además, el cloro fue útil, y en la industria farmacéutica. Los medicamentos que contienen cloro, se utiliza para el tratamiento de infecciones, alergias y diabetes. Neutral forma de clorhidrato de – un componente de muchos medicamentos. El cloro se utiliza para la esterilización de equipos médicos y desinfección. En la agricultura, el cloro es un componente de muchos comerciales de plaguicidas: ddt (дихлородифенилтрихлорэтан) se ha utilizado como insecticida agrícola, pero su uso fue descontinuado.

- Bromo, gracias a su негорючести, se utiliza para inhibir la combustión. También se encuentra en el бромистом метиле, пестициде, utilizado para el almacenamiento de la cosecha y de la supresión de las bacterias. Sin embargo, el uso excesivo de metilbromuro se suspendió debido a sus efectos en la capa de ozono. El bromo se aplican en la producción de la gasolina, de la película, los extintores de incendios, medicamentos para el tratamiento de la neumonía y la enfermedad de alzheimer.
- El Yodo juega un papel importante en el funcionamiento adecuado de la glándula tiroides. Si el cuerpo no recibe suficiente cantidad de yodo, se produce un aumento de la glándula tiroides. Para la prevención del bocio este halo añaden en поваренную sal. El yodo también se utiliza como antiséptico de la herramienta. El yodo contiene en las soluciones utilizadas parala limpieza de heridas abiertas, así como en la desinfección спреях. Además, el yoduro de plata, tiene gran importancia en las fotos.
- Po – radiactivo y редкоземельный halógenos, por lo que no se haya utilizado. Sin embargo, creen que este elemento puede ayudar a йоду en la regulación de las hormonas de la tiroides.
Article in other languages:

Alin Trodden - autor del artículo, editor
"Hola, soy Alin Trodden. Escribo textos, leo libros y busco impresiones. Y no soy mala para decírtelo. Siempre estoy feliz de participar en proyectos interesantes."
Noticias Relacionadas Con La
Francesa burguesa en revolución
Francesa burguesa, la revolución estalló, no en el vacío. La chispa para la ignición, han servido de los siguientes eventos.A finales de los años 80 del siglo 18 en francia sufrido las consecuencias de los desastres naturales que ...
Era de desarrollo de la Tierra continuaron diferente número de años. Se incluyeron en nosotros y en diferentes períodos. Кайнозойская era es la última y geológica de la época. Su duración – 65 millones de años. Se divide Кай...
La Junta Directiva De Aleksey Mijáilovich Тишайшего. La orden de Secreto de los asuntos
la Institución de la orden de Secretos de estado de asuntos exteriores (año de la formación de aproximadamente 1653-th), iniciada por alexei Михайловичем Тишайшим, perseguía dos objetivos. Por un lado, se utilizó como individual, ...
Esaul es el título de la na kazachyem ejército
el capitán de – es un oficio en na kazachyem el ejército. Primero como se llamaba el ayudante general del ejército, más tarde есаула acero asimilar a ротмистру o al capitán. Lo que significa esta palabra?Etimología de la pal...
Tanya Савичева: biografía, sitiada diario y datos interesantes
Normal de leningrado niña tania Савичева se hizo conocido en todo el mundo gracias a su diario, que se llevó en 1941 – 1942 se durante el bloqueo de leningrado. Este folleto se ha convertido en uno de los principales símbolo...
ya en aquellos tiempos remotos, cuando los antepasados de la persona sólo hicieron sus primeros pasos significativos sobre el planeta, la atención de muchos приковывала la Luna. ¿Por qué? Todo es simple! Los padres saben que inclu...






















Comentarios (0)
Este artículo no tiene comentarios, se el primero!