Now - 04:57:47
Halogenki: właściwości fizyczne, właściwości chemiczne. Zastosowanie halogenów i ich związków
Halogenki w układzie okresowym znajduje się na lewo od gazów szlachetnych. Te pięć toksycznych niemetalowych elementów wchodzą w 7 grupie układu okresowego. Należą do nich fluor, chlor, brom, jod i astat. Chociaż astat radioaktywna i ma tylko krótkotrwałe izotopy, zachowuje się, jak jod, i często są dopuszczane do галогенам. Ponieważ halogenowe elementy mają siedem валентных elektronów, im potrzebny jest tylko jeden dodatkowy elektron dla edukacji pełnego oktetu. Ta cecha sprawia, że są bardziej aktywne niż inne grupy niemetali.
Informacje Ogólne
Halogenki tworzą двухатомные cząsteczki (typ X2, gdzie X oznacza atom halogenu) – stabilną formę istnienia halogenów w postaci wolnych elementów. Związki tych двухатомных cząsteczek są неполярными, ковалентными i pojedyncze. Właściwości chemiczne halogenów pozwalają im łatwo wejść w połączenie z większością elementów, więc nigdy nie występują w formularzu niezwiązanym postaci w naturze. Fluor – najbardziej aktywny halogen, a astat ó najmniej.
Wszystkie halogenki tworzą soli I grupy o podobnych właściwościach. W tych połączeniach halogenki są obecne w postaci halide anionów z opłat -1 (na przykład, Cl-, Br-). Zakończenie -id wskazuje jest halogenek-anion, np. Cl- o nazwie «chlorek”.
Ponadto, właściwości chemiczne halogenów pozwalają im działać jako utleniaczy ó zakwaszania metale. Większość reakcji chemicznych, w których biorą udział halogenki ó redoks w roztworze wodnym. Halogenki tworzą pojedyncze związku z węglem lub azotem w organicznych związkach, gdzie stopień ich utleniania (Z) jest równa -1. Kiedy atom halogenu zastąpiony ковалентно-związanym atomem wodoru w rolnictwie połączeniu, prefiks halo - może być stosowany w ogólnym sensie, lub prefiksy fluoro-, chloro-, bromo- , jod- – dla konkretnych halogenów. Halogenowe elementy mogą mieć krzyżowe połączenia z wykształceniem двухатомных molekuły polarne ковалентными pojedynczymi związkami.
Bardziej:
Główne etapy rozwoju psychiki w филогенезе
Rozwój psychiki w филогенезе charakteryzuje się kilkoma etapami. Rozważmy dwie główne historie związane z tym procesem.Филогенез - to historyczny rozwój, obejmującego miliony lat ewolucji, historię rozwoju różnych gatunków organizmów żywych.Ontogenez...
Co to jest gronkowiec i metody jego leczenia
Wielu w swoim życiu miał do czynienia z zakażeniem gronkowca. Dlatego konieczne jest posiadanie pełnej informacji o tej chorobie, aby w pełni zrozumieć, co dzieje się w organizmie. Więc co to jest gronkowiec? To bakterie, lub jedną z ich odmian, z kt...
Przed podjęciem się, że studiuje morfologia, należy zauważyć, że sam studiuje ten dział gramatyki. Tak, morfologia studiuje słowo jako część mowy, a także sposoby jego edukacji, jego formy, struktury i gramatyki wartości, a także poszczególne j...
Chlor (Cl2) stał się pierwszym галогеном, odkryty w 1774 r., a następnie zostały otwarte jod (I2), brom (Br2), fluor (F2) i astat (At, wykryto ostatnim, w 1940 r.). Tytuł óhalogen» pochodzi od greckich korzeni hal- («sól») i -gen («tworzyć»). Razem te słowa oznaczają, że «солеобразующий», podkreślając fakt, że halogenki, wchodząc w reakcję z metalami, tworząc sole. Halit – to nazwa soli kamiennej, naturalnych wód mineralnych, składającego się z chlorku sodu (NaCl). I wreszcie, halogenki są używane w codziennym życiu – fluor zawarty w paście do zębów, chlor dezynfekuje wodę pitną, a jod przyczynia się do wytwarzania hormonów tarczycy.
Pierwiastki
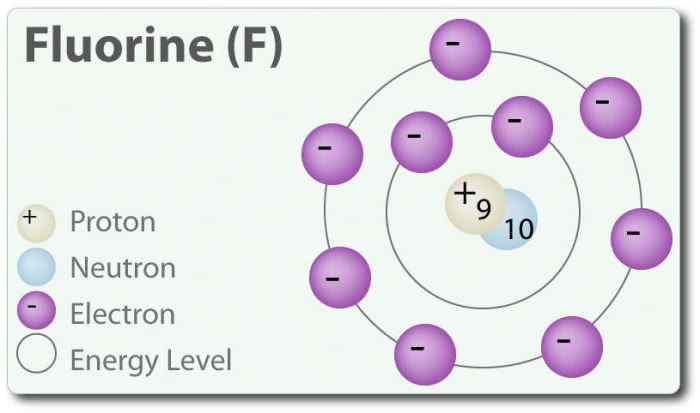
Fluor ó element o liczbie atomowej 9, oznaczona symbolem F. Elementarnego fluoru po raz pierwszy został wykryty w 1886 r. poprzez wydzielenie go z kwasu fluorowodorowego. W stanie wolnym fluor występuje w postaci двухатомной cząsteczki (F2) i jest najczęściej галогеном w skorupie ziemskiej. Fluor – najbardziej электроотрицательный element w układzie okresowym. W temperaturze pokojowej jest blado-żółtym gazem. Fluor ma również stosunkowo mały promień atomowy. Jego Z – -1, za wyjątkiem elementarnej двухатомного stanu, w którym jego stopień utlenienia wynosi zero. Fluor jest bardzo aktywny chemicznie i bezpośrednio komunikuje się ze wszystkimi elementami, z wyjątkiem helu (He), neon (Ne) i argonu (Ar). W roztworze H2O, kwasu fluorowodorowego (HF) jest słabym kwasem. Chociaż fluor mocno электроотрицателен, jego elektroujemność nie określa kwasowość; HF jest słabym kwasem i w związku z tym, że jon fluoru podstawowy (ph> 7). Ponadto, fluor wytwarza bardzo silne utleniacze. Na przykład, fluor może wejść w reakcję z gazem ksenonem i tworzy silny utleniacz дифторид ksenonu (XeF2). U fluoru wiele zastosowań.
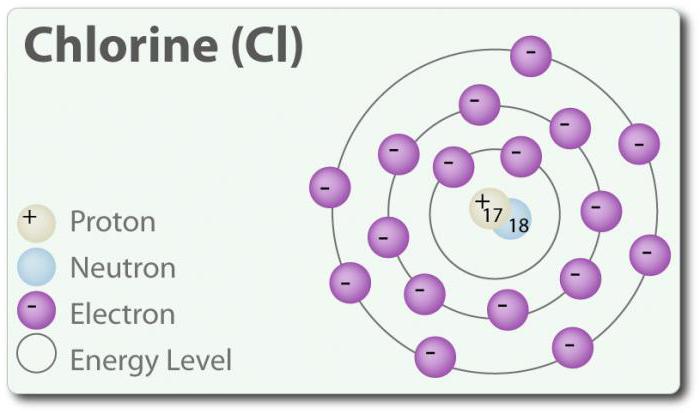
Chlor ó element o liczbie atomowej 17 i chemicznym symbolem Cl. Odkryty w 1774 r. poprzez wydzielenie go z kwasu solnego. W swoim podstawowym stanie tworzy двухатомную molekułę Cl2. Chlor ma kilka Z: -1, +1, 3, 5 i 7. W temperaturze pokojowej jest jasno-zielonym gazem. Tak jak więź, która powstaje między dwoma atomami chloru, jest słaba, cząsteczka Cl2 ma bardzo wysoką zdolność do zrzeszania się w związki. Chlor reaguje z metalami z wytworzeniem soli, które nazywane są chlorki. Jony chloru są najbardziej powszechne jonami, są one zawarte w wodzie morskiej. Chlor ma również dwóch izotopów: 35Cl 37Cl. Chlorek sodu jest najczęściej połączeniem ze wszystkich chlorków.
Brom ó pierwiastek chemiczny o liczbie atomowej 35 i symbolem Br. Po raz pierwszy została odkryta w 1826 r. W elementarnej formie brom jest двухатомной molekułą Br2. W temperaturze pokojowej jest czerwonawo-brązową ciecz. Jego Z – -1, + 1, 3, 4 i 5. Brom jest bardziej aktywny niż jod, ale mniej aktywny niż chlor. Ponadto, brom ma dwóch izotopów: 79Sh i 81Sh. Brom występuje w postaci soli bromku, rozpuszczonych w wodzie morskiej. W ostatnich latach produkcja ipratropium w świecie znacznie wzrosła ze względu na jego dostępność i długim czasie życia. Jak i inne halogenki, bromjest utleniaczem i jest bardzo toksyczny.
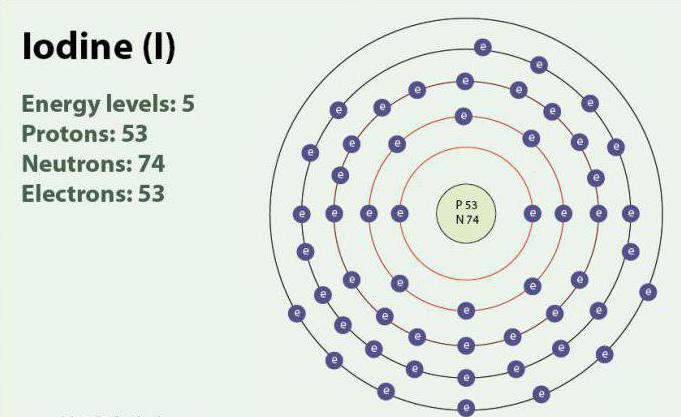
Jod ó pierwiastek chemiczny o liczbie atomowej 53 i symbolem I. Jod ma stopień utlenienia: -1, +1, +5 i +7. Istnieje w postaci двухатомной molekuły, I2. W temperaturze pokojowej jest stały substancją koloru fioletowego. Jod ma jeden trwały izotop - 127I. po raz Pierwszy odkryty w 1811 r. z pomocą alg morskich i kwasu siarkowego. Obecnie jony jodu, mogą być wyróżnione w wodzie morskiej. Mimo, że jod nie jest bardzo dobrze rozpuszczalny w wodzie, jego rozpuszczalność może wzrosnąć w przypadku pojedynczych йодидов. Jod odgrywa ważną rolę w organizmie, uczestniczy w produkcji hormonów tarczycy.
Astat ó radioaktywny pierwiastek o liczbie atomowej 85 i symbolem At. Jego możliwe stopnie utlenienia: -1, +1, 3, 5 i 7. Jedyny halogen, nie jest двухатомной molekułą. W normalnych warunkach jest metalowym twarde substancją koloru czarnego. Astat jest bardzo rzadkim elementem, dlatego o nim wiadomo niewiele. Ponadto, astat ma bardzo krótki okres półtrwania, nie dłużej niż kilka godzin. Uzyskany w 1940 r. w wyniku syntezy. Uważa się, że astat jak na jod. Wyróżnia się metalowymi właściwości.
W tabeli poniżej przedstawiono strukturę atomów halogenu, struktura zewnętrznej warstwy elektronów.
Halogen | Konfiguracja elektronów |
Fluor | 1s2 22 2p5 |
Chlor | 3s2 3p5 |
Brom | 3d10 4s2 4p5 |
Isp | 4d10 5s2 5p5 |
Astat | 4f14 5d10 6s2 6p5 |
Takiego budowa zewnętrznej warstwy elektronów sprawia, że to, co fizyczne i chemiczne właściwości halogenów podobne. Jednak przy porównaniu tych elementów są i różnice.
Okresowe właściwości w grupie halogenów
Właściwości Fizyczne substancji prostych halogenów zmieniają się wraz ze wzrostem liczby seryjnej elementu. Dla lepszego wchłaniania i większej przejrzystości oferujemy państwu kilka tabel.
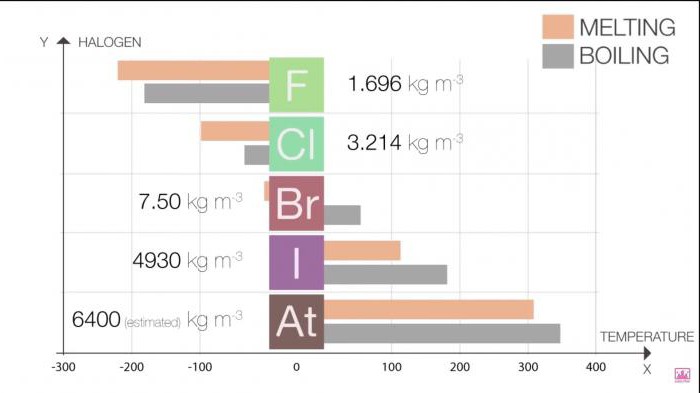
Temperatury topnienia i wrzenia w grupie wzrasta w miarę wzrostu wielkości cząsteczki (F <Cl <Br <I <At). Ten wzrost oznacza zwiększenie siły Van der Waalsa.
Tabela 1. Halogenki. Właściwości fizyczne: temperatury topnienia i wrzenia
Halogen | T topnienia (C) | T wrzenia (C) |
Fluor | -220 | -188 |
Chlor | -101 | -35 |
Brom | -7.2 | 58.8 |
Isp | 114 | 184 |
Astat | 302 | 337 |
- Promień Atomowy wzrasta.
Rozmiar jądra wzrasta (F < Cl < Br < I < At), ponieważ zwiększa się liczba protonów i neutronów. Ponadto, z każdym okresem dodaje się coraz więcej poziomów energii. To prowadzi do większej orbitale, i, w konsekwencji, do zwiększenia promienia atomu.
Tabela 2. Halogenki. Właściwości fizyczne: promienie atomowe
Halogen | Promień Walencyjny (pw) | Jonowy (X-) promień (pw) |
Fluor | 71 | 133 |
Chlor | 99 | 181 |
Brom | 114 | 196 |
Isp | 133 | 220 |
Astat | 150 |
- Energia jonizacji maleje.
Jeśli zewnętrzne elektrony walencyjne nie znajdują się w pobliżu jądra, w celu ich usunięcia od niego nie wymaga dużo energii. W ten sposób energia potrzebna do wypychania zewnętrznego elektronu nie jest tak wysoki w dolnej części grupy elementów, tak jak tutaj więcej poziomów energetycznych. Ponadto, wysoka energia jonizacji sprawia, że element zachować niemetalowe jakości. Jod i wyświetlacz astat metalowe wykazują właściwości, ponieważ energia jonizacji maleje (At < I < Br < Cl < F).
Tabela 3. Halogenki. Właściwości fizyczne: energia jonizacji
Halogen | Energia jonizacji (kj/mol) |
Fluor | 1681 |
Chlor | 1251 |
Brom | 1140 |
Jod | 1008 |
Astat | 890±40 |
- Elektroujemność maleje.
Liczba валентных elektronów w atomie wzrasta wraz ze wzrostem poziomu energii przy coraz niższych poziomach. Elektrony progresywnie dalej od jądra; w Ten sposób jądro i elektrony nie przyciągajądo siebie. Wzrost ekranowania obserwuje. Dlatego Elektroujemność maleje wraz ze wzrostem okresu (At < I < Br < Cl < F).
Tabela 4. Halogenki. Właściwości fizyczne: elektroujemność
Halogen | Elektroujemność |
Fluor | 4.0 |
Chlor | 3.0 |
Brom | 2.8 |
Isp | 2.5 |
Astat | 2.2 |
- Powinowactwo elektronowe zmniejsza się.
Tak jak rozmiar atomu wzrasta wraz ze wzrostem okresu, powinowactwo elektronowe, zazwyczaj zmniejsza się (Na < I < Br < F < Cl). Wyjątek ó fluor, powinowactwo którego mniej niż chloru. Można to wyjaśnić mniejszym rozmiarze fluoru w porównaniu z chlorem.
Tabela 5. Powinowactwo halogenów elektronowe
Halogen | Powinowactwo elektronowe (kj/mol) |
Fluor | -328.0 |
Chlor | -349.0 |
Brom | -324.6 |
Isp | -295.2 |
Astat | -270.1 |
- Reaktywność elementów zmniejsza się.
Reaktywność halogenków spada wraz ze wzrostem okresu (At <I <Br <Cl <F). Jest to związane ze wzrostem promienia atomu wraz ze wzrostem poziomów energii elektronów. To zmniejsza przyciąganie валентных elektronów innych atomów, zmniejszenie reaktywności. Zmniejszenie to również dzieje się z powodu spadku электроотрицательности wraz ze wzrostem okresu, co również zmniejsza przyciąganie elektronów. Ponadto, wraz ze wzrostem wielkości atomu zmniejsza się i окислительная zdolność.
Chemia Nieorganiczna. Wodór + halogenki
Halogenek powstaje, gdy halogen reaguje z innym, mniej электроотрицательным elementem edukacji binarnego połączenia. Wodór reaguje z halogenów, tworząc halogenki typu HX:
- Fluorowodór HF;
- Chlorowodór HCl;
- бромоводород HBr;
- иодоводород HI.
Halogenki wodoru łatwo rozpuszczają się w wodzie tworząc галогенводородной (fluorowodorowego, kwasu solnego, бромистоводородной, иодистоводородной) kwasu. Właściwości tych kwasów znajdują się poniżej.
Kwasy powstają poniższej reakcji: HX (aq) + H2O (l) → X- (aq) + H3O+ (aq).
Wszystkie галоидоводороды tworzą silne kwasy, za wyjątkiem HF.
Kwasowość галогеноводородных kwasów wzrasta: HF <HCl <HBr <HI.
Плавиковая kwas jest w stanie wygrawerować szkło i niektóre nieorganiczne фториды długi czas.
Może się to wydawać sprzeczne z intuicją, że HF jest najsłabszy галогенводородной kwasem, tak jak fluor ma najwyższą электроотрицательностью. Jednak związek N-F jest bardzo silna, w wyniku czego kwas jest bardzo słaba. Silna więź zależy krótkiej długości komunikacji i wielką energią dysocjacji. Z wszystkich halogenków wodoru HF ma najkrótszą długość komunikacji i największą energię dysocjacji związku.
Halogenowe оксокислоты
Halogenowe оксокислоты stanowią kwasy z atomami wodoru, tlenu i halogenu. Ich kwasowość może być określony za pomocą analizy struktury. Halogenowe оксокислоты przedstawiono poniżej:
- Хлорноватистая kwas HOCl.
- Хлористая kwas HClO2.
- Хлорноватая kwas HClO3.
- Хлорная kwas HClO4.
- Бромноватистая kwas HOBr.
- Бромноватая kwas HBrO3.
- Бромная kwas HBrO4.
- Иодноватистая kwas HOI.
- Йодноватая kwas HIO3.
- Метайодная kwas HIO4, H5IO6.
W każdym z tych kwasów proton jest związana z atomem tlenu, więc porównywanie długości wiązań protonów tutaj nie ma sensu. Dominującą rolę odgrywa tu elektroujemność. Aktywność są acidic wzrasta wraz ze wzrostem liczby atomów tlenu związany z centralnym atomem.
Wygląd i stan materii
Podstawowe właściwości fizyczne halogenów krótko można wyrazić w poniższej tabeli.
Stan materii (w temperaturze pokojowej) | Halogen | Wygląd |
Ciało stałe | Jod | I fioletowy |
Astat | Czarny | |
Płynny | Brom | Czerwono-brązowy |
Gazowe | Fluor | Blado-żółto-brązowy |
Chlor | Blado-zielone |
Wyjaśnienie wyglądu
Kolor halogenów jest wynikiem absorpcji światła widzialnego cząsteczek, co powoduje wzbudzenie elektronów. Fluor pochłania fioletowe światło i stąd wygląda jasno-żółtym. Jod, wręcz przeciwnie, pochłania światło żółte i wygląda fioletowym (żółty i fioletowy ó uzupełniające kolory). Kolor halogenów staje się ciemniejszy ze wzrostem okresu.
W zamkniętych pojemnikach ciekły brom i twarda jod są w równowadze ze swoimi parami, które można obserwować w postaci kolorowego gazu.
Chociaż kolor астата nie jest znany, przyjmuje się, że powinien być ciemniejszy jodu (czyli czarny) zgodnie z dostrzegalnym закономерностью.
Teraz, jeśli zostaniesz poproszony o: «należy określić właściwości fizyczne halogenów», będzie co powiedzieć.
Stopień utleniania halogenów w związkach
Stopień utleniania często używany zamiast pojęcia "valence halogenów". Zazwyczaj stopień utlenienia równy -1. Ale jeśli halogen jest związana z tlenem lub innym галогеном, może podejmować inne stany: Z tlenu -2 ma pierwszeństwo. W przypadku dwóch różnych atomów halogenu, połączonych razem, bardziej электроотрицательный atom zwycięża i bierze Z -1.
Na Przykład, w chlorek jodu (ICl) chlor ma Z -1, i jod +1. Chlor jest bardziej электроотрицательным, niż jod, dlatego ZE jest równa -1.
W бромной kwas (HBrO4) tlen ma Z -8 (-2 x 4 atomu = -8). Wodór ma ogólny stopień utlenienia +1. Dodawanie tych wartości daje ZE -7. Tak jak skończone Z połączenia powinno być zero, to ZE bromu wynosi +7.
Trzeci wyjątkiem od reguły jest stopień utleniania halogenu w podstawowej formie (X2), gdzie Z jest równa zero.
Halogen | ZE w złączach |
Fluor | -1 |
Chlor | -1, +1, +3, +5, +7 |
Brom | -1, +1, +3, +4, +5 |
Jod | -1, +1, +5, +7 |
Astat | -1, +1, +3, +5, +7 |
Dlaczego ZE fluoru zawsze -1?
Elektroujemność rośnie wraz ze wzrostem okresu. Dlatego fluor ma wysoką elektroujemność z wszystkich elementów, co potwierdza jego położeniem w układzie okresowym. Jego konfiguracja elektronowa 1s2 22 2p5. Jeśli fluor dostaje jeszcze jeden elektron, skrajne p-orbitale całkowicie wypełnione i tworzą kompletny oktet. Ponieważ fluor ma wysoką elektroujemność, może łatwo odebrać elektron u sąsiedniego atomu. Fluor w tym przypadku изоэлектронен инертному gazie (z ośmioma валентными elektronami), wszystkie jego zewnętrzne orbitale są wypełnione. W takim stanie fluor jest znacznie bardziej stabilny.
Otrzymywanie i zastosowanie halogenów
W naturze halogenki są w stanie anionów, więc temat halogenki otrzymywany metodą utleniania przez elektrolizę lub za pomocą utleniaczy. Na przykład chlor jest wytwarzany w wyniku hydrolizy roztworu soli kuchennej. Zastosowanie halogenów i ich związków zróżnicowane.
- Fluor. Mimo, że fluor jest bardzo reaktywny, jest on stosowany w wielu dziedzinach przemysłu. Na przykład, on jest kluczowym elementów ptfe (teflonu) i niektórych innych фторполимеров. Chlorofluorowęglowodory stanowią organiczne substancje chemiczne, które wcześniej były wykorzystywane jako czynników chłodniczych i пропеллентов w аэрозолях. Ich zastosowanie ustało z powodu ewentualnego ich wpływu na środowisko. Zastąpiły je z odzysku. Fluor dodawany do pasty do zębów (SnF2) i wodę (NaF) w celu uniknięcia zniszczenia zębów. Ten halogen zawiera w glinie, używanego do produkcji niektórych rodzajów ceramiki (LiF), używane w energetyce jądrowej (UF6), aby uzyskać antybiotyk фторхинолона, aluminium (Na3AlF6), dla izolacji urządzeń wysokiego napięcia (SF6).
- Chlor również znaleźć różnorodne zastosowanie. Jest on używany do dezynfekcji wody pitnej i basenów. Podchloryn sodu (NaClO) jest głównym składnikiem wybielaczy. Kwas solny jest szeroko stosowany w przemyśle i laboratoriach. Chlor obecny w поливинилхлориде (PVC) i innych polimerów, które są używane do izolacji przewodów, rur i elektroniki. Ponadto, chlor okazał się przydatny i w przemyśle farmaceutycznym. Leki zawierające chlor, są używane do leczenia infekcji, alergii i cukrzycy. Neutralna forma chlorowodorku – składnik wielu leków. Chlor używany jest również do sterylizacji sprzętu szpitalnego i dezynfekcji. W rolnictwie chlor jest składnikiem wielu komercyjnych pestycydów: DDT (дихлородифенилтрихлорэтан) był używany jako rolnych środek owadobójczy, ale jego wykorzystanie zostało zakończone.

- Brom, dzięki swojej негорючести, stosuje się do redukcji spalania. On również zawiera w бромистом bromek, пестициде, używanym do przechowywania zbiorów i eliminacji bakterii. Jednak nadmierne stosowanie bromku metylu przerwano z powodu jego wpływu na warstwę ozonową. Brom jest stosowany przy produkcji benzyny, na kliszy fotograficznej, gaśnic, leki stosowane w leczeniu zapalenia płuc i choroby Alzheimera.
- Jod odgrywa ważną rolę w prawidłowym funkcjonowaniu tarczycy. Jeśli organizm nie otrzymuje wystarczającej ilości jodu, następuje powiększenie tarczycy. Dla zapobiegania wole ten halogen dodaje się do soli kuchennej. Jod również używany jako antyseptyka. Jod zawarty w roztworach stosowanych dooczyścić otwartych ran, a także w dezynfekcyjnych спреях. Ponadto, jodek srebra jest ważne w fotografii.
- Astat – radioaktywny i pierwiastki ziem rzadkich halogen, więc jeszcze nigdzie nie jest używany. Niemniej jednak uważa się, że ten element może pomóc jod w regulacji hormonów tarczycy.
Article in other languages:

Alin Trodden - autor artykułu, redaktor
"Cześć, jestem Alin Trodden. Piszę teksty, czytam książki, Szukam wrażeń. I nie jestem zły w opowiadaniu ci o tym. Zawsze chętnie biorę udział w ciekawych projektach."
Nowości
Zarząd Aleksieja Michajłowicza Тишайшего. Rozkaz Tajnych spraw
Instytucja rozkazów Tajnych spraw (rok formacji około 1653-th), inicjowane Przez Михайловичем Тишайшим, ścigał dwa cele. Z jednej strony, był on używany jako prywatna kancelaria suwerena. Z drugiej - rozkaz Tajnych spraw występowa...
Есаул - to tytuł w kozackiej armii
Есаул – to klasa w kozackiej armii. Najpierw tak nazywał się pomocnik wodza, później есаула stały się dorównać do ротмистру lub kapitanowi. Co oznacza to słowo?Etymologia słowaWedług jednej z wersji "есаул" – jest to s...
Tania Savicheva: biografia, блокадный pamiętnik i ciekawe fakty
Zwykły leningrad dziewczyna Tanya Savicheva stała się znana na cały świat dzięki swojemu dziennika, który prowadził w 1941 ó w 1942 r. podczas blokady Leningradu. Ta książeczka stała się jednym z głównych symboli tych stras...
W jakich przypadkach stawia się przecinek? Przecinki w zdaniach: zasady
Przecinek – najbardziej proste i przyziemne, ale w tym samym czasie i najbardziej podstępny znak. Jej inscenizacja oznacza zrozumienie tego, jak jest zbudowany i структурируется przemówienie, jakie znaczenie pojawiają się i ...
Atomowej абсорбционный mas MHA
W tym artykule omówimy pojęcie atomowej absorpcji mas i zakresu badania, w którym produkt jest stosowany. Również zajmiemy się uwagę ogólnej definicji narzędzia analitycznego różnych danych historycznych i zasad urządzeń używanych...
W pomocy uczeń: definicja, rodzaje i przykłady antonimów
Antonimy - to słowa, które mają różne brzmienia i mają przeciwne znaczenia: kłamstwo - prawda, zły - dobry, cicho - mówił. Przykłady antonimów wskazują, że należą one do tej samej części mowy.Антонимия w języku polskim przedstawio...






















Uwaga (0)
Ten artykuł nie ma komentarzy, bądź pierwszy!