Галагены: фізічныя ўласцівасці, хімічныя ўласцівасці. Прымяненне галагенаў і іх злучэнняў
Галагены у перыядычнай табліцы размешчаны злева ад высакародных газаў. Гэтыя пяць таксічных неметалічных элементаў ўваходзяць у 7 групу перыядычнай табліцы. Да іх ставяцца фтор, хлор, бром, ёд і астат. Хоць астат радиоактивен і мае толькі кароткачасовых ізатопы, ён паводзіць сябе, як ёд, і яго часта адносяць да галогенам. Паколькі галагенавыя элементы маюць сем валентных электронаў, ім неабходны толькі адзін дадатковы электрон для адукацыі поўнага актэта. Гэтая характарыстыка робіць іх больш актыўнымі, чым іншыя групы неметаллов.
Агульная характарыстыка
Галагены ўтвараюць двухатомные малекулы (выгляду Х2, дзе Х пазначае атам галаген) – ўстойлівую форму існавання галагенаў ў выглядзе свабодных элементаў. Сувязі гэтых двухатомный малекул з'яўляюцца неполярными, кавалентная і адзінарнымі. Хімічныя ўласцівасці галагенаў дазваляюць ім лёгка ўступаць у злучэнне з большасцю элементаў, таму яны ніколі не сустракаюцца ў несвязанном выглядзе ў прыродзе. Фтор – найбольш актыўны галаген, а астат – найменш.
Усе галагены ўтвараюць солі I групы з падобнымі ўласцівасцямі. У гэтых злучэннях галагены прысутнічаюць у выглядзе галоидных аніёнаў з зарадам -1 (напрыклад, Cl-, Br-). Канчатак -ід паказвае на наяўнасць галагенід-аніёнаў; напрыклад Cl- называецца «хларыд».
Акрамя таго, хімічныя ўласцівасці галагенаў дазваляюць ім дзейнічаць у якасці акісляльнікаў – акісляць металы. Большасць хімічных рэакцый, у якіх удзельнічаюць галагены – акісляльна-аднаўленчыя ў водным растворы. Галагены ўтвараюць адзінарныя сувязі з вугляродам або азотам ў арганічных злучэннях, дзе ступень іх акіслення (З) роўная -1. Калі атам галаген замешчаны кавалентна-звязаных атамам вадароду ў арганічным злучэнні, прэфікс гало - можа быць выкарыстаны ў агульным сэнсе, або прэфіксы фтор-, хлор-, бром- , ёд- – для канкрэтных галагенаў. Галагенавыя элементы могуць мець крыжаваную сувязь з адукацыяй двухатомный малекул з палярнымі кавалентная адзінарнымі сувязямі.
Больш:
Нервовы імпульс, яго пераўтварэнне і механізм перадачы
Нервовая сістэма чалавека выступае своеасаблівым каардынатарам у нашым арганізме. Яна перадае каманды ад мозгу мускулатуры, органаў, тканін і апрацоўвае сігналы, якія ідуць ад іх. У якасці своеасаблівага носьбіта дадзеных выкарыстоўваецца нервовы імп...
Куды паступаць пасля 11 класа? Якую выбраць прафесію?
Пры выбары сваёй будучай прафесіі не варта абапірацца на чые-то рэкамендацыі і парады, тым больш не трэба падпарадкоўвацца сваім бацькам, якія даволі часта вырашаюць без вас самастойна, куды паступіць пасля 11 класа. Варта задумацца, наколькі паспяхо...
Крывяносная сістэма жывёл, як вынік эвалюцыйнага развіцця свету
Крывяносная сістэма жывёл прайшла доўгі шлях фарміравання ў ходзе эвалюцыйнага развіцця свету. Яна ўтварылася на месцы рудыментарных частак першаснай паражніны цела, якая ў вышэйшых жывёл была выцесненая целломом, або другаснай паражніной цела. У пра...
Хлор (Cl2) стаў першым галагенавымі, адкрытым у 1774 г., затым былі адкрыты ёд (I2), бром (Br2), фтор (F2) і астат (At, знойдзены апошнім, у 1940 г.). Назва «галаген» паходзіць ад грэчаскіх каранёў hal- («соль») і -gen («утвараць»). Разам гэтыя словы азначаюць «солеобразующий», падкрэсліваючы той факт, што галагены, уступаючы ў рэакцыю з металамі, ўтвараюць солі. Галит – гэта назва каменнай солі, прыроднага мінерала, які складаецца з хларыду натрыю (NaCl). І, нарэшце, галагены выкарыстоўваюцца ў побыце – фтарыд змяшчаецца ў зубной пасце, хлор абеззаражвае пітную ваду, а ёд садзейнічае выпрацоўцы гармонаў шчытападобнай залозы.
Хімічныя элементы
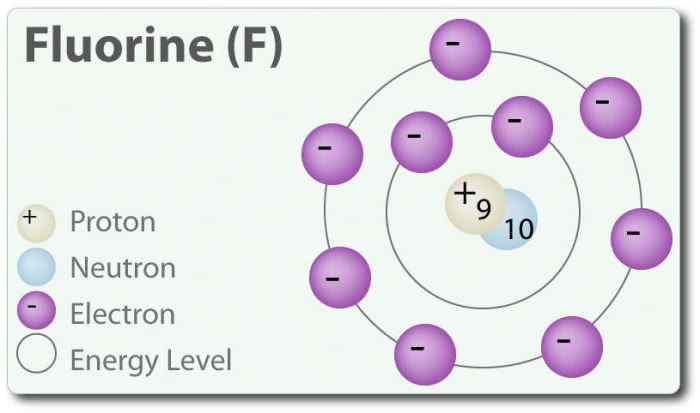
Фтор – элемент з атамным нумарам 9, пазначаецца сімвалам F. Элементарны фтор ўпершыню быў знойдзены ў 1886 г. шляхам выдзялення яго з плавікавай кіслаты. У вольным стане фтор існуе ў выглядзе двухатомной малекулы (F2) і з'яўляецца найбольш распаўсюджаным галагенавымі ў зямной кары. Фтор – найбольш электроотрицательный элемент у перыядычнай табліцы. Пры пакаёвай тэмпературы з'яўляецца бледна-жоўтым газам. Фтор таксама мае адносна невялікі атамны радыус. Яго СА – -1, за выключэннем элементарнага двухатомного стану, у якім яго ступень акіслення роўная нулю. Фтор надзвычай хімічна актыўны і непасрэдна ўзаемадзейнічае з усімі элементамі, акрамя гелія (He), неон (Ne) і аргону (Ar). У растворы H2O, плавікавай кіслаты (HF) з'яўляецца слабой кіслатой. Хоць фтор моцна электроотрицателен, яго электраадмо не вызначае кіслотнасць; HF з'яўляецца слабой кіслатой ў сувязі з тым, што іён фтору асноўны (рН> 7). Акрамя таго, фтор вырабляе вельмі магутныя акісляльнікі. Напрыклад, фтор можа ўступаць у рэакцыю з інэртным газам ксэнонам і ўтварае моцны акісляльнік дзве ксэнону (XeF2). У фтору мноства ужыванняў.
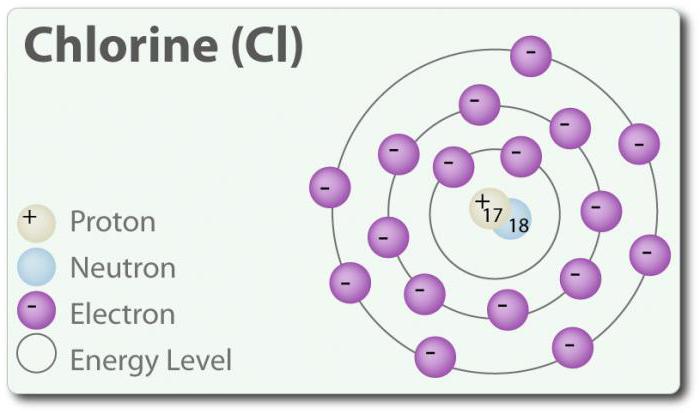
Хлор – элемент з атамным нумарам 17 і хімічным сімвалам Cl. Знойдзены ў 1774 г. шляхам выдзялення яго з салянай кіслаты. У сваім элементарным стане ён утворыць двухатомную малекулу Cl2. Хлор мае некалькі З: -1, +1, 3, 5 і 7. Пры пакаёвай тэмпературы ён з'яўляецца светла-зялёным газам. Так як сувязь, якая ўтвараецца паміж двума атамамі хлору, з'яўляецца слабой, малекула Cl2 валодае вельмі высокай здольнасцю ўступаць у злучэння. Хлор рэагуе з металамі з адукацыяй соляў, якія называюцца хларыды. Іёны хлору з'яўляюцца найбольш распаўсюджанымі іёнамі, яны ўтрымліваюцца ў марской вадзе. Хлор таксама мае два ізатопа: 35Cl і 37Cl. Хларыд натрыю з'яўляецца найбольш распаўсюджаным злучэннем з усіх хларыдаў.
Бром – хімічны элемент з атамным нумарам 35 і сімвалам Br. Упершыню быў знойдзены ў 1826 г. У элементарнай форме бром з'яўляецца двухатомной малекулай Br2. Пры пакаёвай тэмпературы ўяўляе сабой чырванавата-карычневую вадкасць. Яго СА – -1, + 1, 3, 4 і 5. Бром больш актыўны, чым ёд, але менш актыўны, чым хлор. Акрамя таго, бром мае два ізатопа: 79Вг і 81Вг. Бром сустракаецца ў выглядзе соляў браміду, раствораных у марской вадзе. За апошнія гады вытворчасць браміду ў свеце значна павялічылася дзякуючы яго даступнасці і працяглага часу жыцця. Як і іншыя галагены, бромз'яўляецца акісляльнікам і вельмі таксічны.
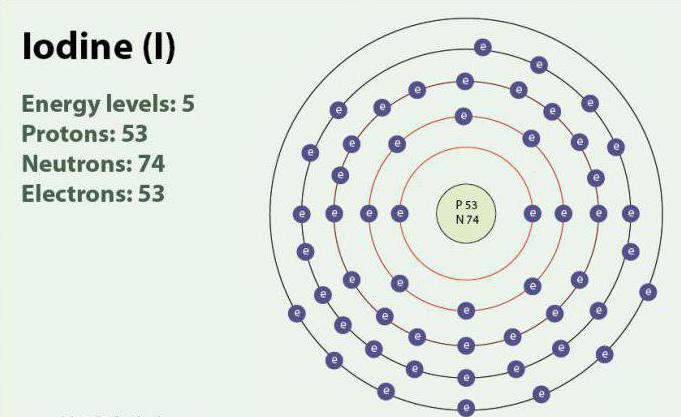
Ёд – хімічны элемент з атамным нумарам 53 і сімвалам I. Ёд мае ступені акіслення: -1, +1, +5 і +7. Існуе ў выглядзе двухатомной малекулы, I2. Пры пакаёвай тэмпературы з'яўляецца цвёрдым рэчывам фіялетавага колеру. Ёд мае адзін стабільны ізатоп - 127I. Упершыню выяўлены ў 1811 г. з дапамогай марскіх багавіння і сернай кіслаты. У цяперашні час іёны ёду, могуць быць вылучаныя ў марской вадзе. Нягледзячы на тое, што ёд не вельмі добра раствараецца ў вадзе, яго растваральнасць можа ўзрасці пры выкарыстанні асобных йодидов. Ёд гуляе важную ролю ў арганізме, удзельнічаючы ў выпрацоўцы гармонаў шчытападобнай залозы.
Астат – радыеактыўны элемент з атамным нумарам 85 і сімвалам At. Яго магчымыя ступені акіслення: -1, +1, 3, 5 і 7. Адзіны галаген, не які з'яўляецца двухатомной малекулай. У нармальных умовах з'яўляецца металічным цвёрдым рэчывам чорнага колеру. Астат з'яўляецца вельмі рэдкім элементам, таму пра яго вядома няшмат. Акрамя таго, астат мае вельмі кароткі перыяд паўраспаду, не даўжэй некалькіх гадзін. Атрыманы ў 1940 г. у выніку сінтэзу. Мяркуюць, што астат падобны на ёд. Адрозніваецца металічнымі ўласцівасцямі.
У табліцы ніжэй паказана будова атамаў галагенаў, структура вонкавага пласта электронаў.
Галаген | Канфігурацыя электронаў |
Фтор | 1s2 2s2 2p5 |
Хлор | 3s2 3p5 |
Бром | 3d10 4s2 4p5 |
Ёд | 4d10 5s2 5p5 |
Астат | 4f14 5d10 6s2 6p5 |
Падобнае будынак вонкавага пласта электронаў абумоўлівае тое, што фізічныя і хімічныя ўласцівасці галагенаў падобныя. Разам з тым пры супастаўленні гэтых элементаў назіраюцца і адрозненні.
Перыядычныя ўласцівасці ў групе галагенаў
Фізічныя ўласцівасці простых рэчываў галагенаў змяняюцца з павелічэннем парадкавага нумара элемента. Для лепшага засваення і большай нагляднасці мы прапануем вам некалькі табліц.
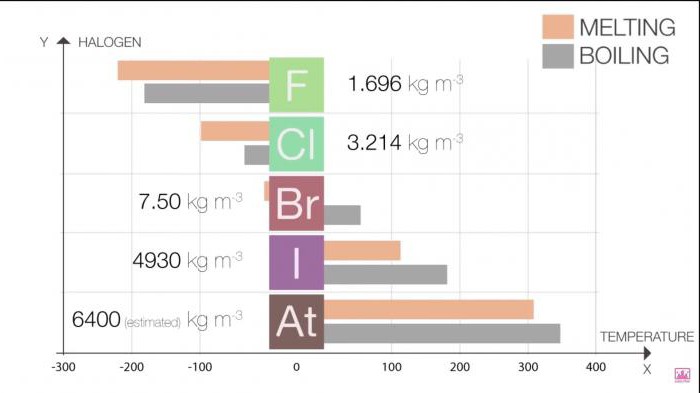
Кропкі плаўлення і кіпення ў групе ўзрастаюць па меры росту памеру малекулы (F <Cl <Br <I <At). Гэта павелічэнне азначае павелічэнне сілы Ван-дэр-Ваальса.
Табліца 1. Галагены. Фізічныя ўласцівасці: кропкі плаўлення і кіпення
Галаген | Т плаўлення (C) | Т кіпення (C) |
Фтор | -220 | -188 |
Хлор | -101 | -35 |
Бром | -7.2 | 58.8 |
Ёд | 114 | 184 |
Астат | 302 | 337 |
- Атамны радыус павялічваецца.
Памер ядра павялічваецца (F < Cl < Br < I < At), так як павялічваецца колькасць пратонаў і нейтронаў. Акрамя таго, з кожным перыядам дадаецца ўсё больш узроўняў энергіі. Гэта прыводзіць да большай арбіталь, і, такім чынам, да павелічэння радыусу атама.
Табліца 2. Галагены. Фізічныя ўласцівасці: атамныя радыусы
Галаген | Ковалентный радыус (пм) | Іённы (X-) радыус (пм) |
Фтор | 71 | 133 |
Хлор | 99 | 181 |
Бром | 114 | 196 |
Ёд | 133 | 220 |
Астат | 150 |
- Энергія іянізацыі памяншаецца.
Калі знешнія валентныя электроны не знаходзяцца паблізу ядра, то для іх выдалення ад яго не спатрэбіцца шмат энергіі. Такім чынам, энергія, неабходная для выштурхоўвання знешняга электрона не гэтак высокая ў ніжняй частцы групы элементаў, так як тут больш энергетычных узроўняў. Акрамя таго, высокая энергія іянізацыі прымушае элемент праяўляць неметалічныя якасці. Ёд і дысплей астат праяўляюць металічныя ўласцівасці, таму што энергія іянізацыі зніжаецца (At < I < Br < Cl < F).
Табліца 3. Галагены. Фізічныя ўласцівасці: энергія іянізацыі
Галаген | Энергія іянізацыі (кДж/моль) |
фтор | 1681 |
хлор | 1251 |
бром | 1140 |
ёд | 1008 |
астат | 890±40 |
- Электраадмо памяншаецца.
Лік валентных электронаў у атаме ўзрастае з павелічэннем узроўняў энергіі пры прагрэсіўна больш нізкіх узроўнях. Электроны прагрэсіўна далей ад ядра; Такім чынам, ядро і электроны не як прыцягваюццаадзін да аднаго. Павелічэнне экранавання назіраецца. Таму Электраадмо памяншаецца з ростам перыяду (At < I < Br < Cl < F).
Табліца 4. Галагены. Фізічныя ўласцівасці: электраадмо
Галаген | Электраадмо |
фтор | 4.0 |
хлор | 3.0 |
бром | 2.8 |
ёд | 2.5 |
астат | 2.2 |
- Сродство да электронных памяншаецца.
Так як памер атама павялічваецца з павелічэннем перыяду, сродство да электронных, як правіла, памяншаецца (У < I < Br < F < Cl). Выключэнне – фтор, падабенства якога менш, чым у хлору. Гэта можна растлумачыць меншым памерам фтору па параўнанні з хлорам.
Табліца 5. Сродство галагенаў да электронных
Галаген | Сродство да электронных (кДж/моль) |
фтор | -328.0 |
хлор | -349.0 |
бром | -324.6 |
ёд | -295.2 |
астат | -270.1 |
- Рэактыўнасць элементаў памяншаецца.
Рэакцыйная здольнасць галагенаў падае з ростам перыяду (At <I <Br <Cl <F). Гэта звязана з павелічэннем радыусу атама з узрастаннем узроўняў энергіі электронаў. Гэта зніжае прыцягненне валентных электронаў іншых атамаў, зніжаючы рэакцыйную здольнасць. Гэта таксама памяншэнне адбываецца з-за падзення электраадмо з павелічэннем перыяду, што таксама зніжае прыцягненне электронаў. Акрамя таго, з павелічэннем памеру атама зніжаецца і акісляльная здольнасць.
Неарганічная хімія. Вадарод + галагены
Галагенід ўтворыцца, калі галаген рэагуе з іншым, менш электраадмо элементам з адукацыяй бінарнага злучэння. Вадарод рэагуе з галагенных, утвараючы галагеніду выгляду НХ:
- фтороводород HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводород HI.
Галагенід вадароду лёгка раствараюцца ў вадзе з адукацыяй галогенводородной (плавікавай, салянай, бромистоводородной, иодистоводородной) кіслаты. Ўласцівасці гэтых кіслот прыведзены ніжэй.
Кіслоты ўтворацца наступнай рэакцыяй: HX (aq) + H2O (l) → Х- (aq) + H3O+ (aq).
Усе галоидоводороды ўтвараюць моцныя кіслоты, за выключэннем HF.
Кіслотнасць галогеноводородных кіслот павялічваецца: HF <HCl <HBr <HI.
Плавікавай кіслата здольная гравіраваных шкло і некаторыя неарганічныя фтарыды доўгі час.
Можа здацца нелагічным, што HF з'яўляецца самай слабой галогенводородной кіслатой, так як фтор валодае самай высокай электроотрицательностью. Тым не менш сувязь Н-F вельмі моцная, у выніку чаго кіслата вельмі слабая. Моцная сувязь вызначаецца кароткай даўжынёй сувязі і вялікай энергіяй дысацыяцыі. З усіх галагенідаў вадароду HF мае самую кароткую даўжыню сувязі і самую вялікую энергію дысацыяцыі сувязі.
Галагенавыя оксокислоты
Галагенавыя оксокислоты ўяўляюць сабой кіслаты з атамамі вадароду, кіслароду і галаген. Іх кіслотнасць можа быць вызначана з дапамогай аналізу структуры. Галагенавыя оксокислоты прыведзены ніжэй:
- Хлорноватистая кіслата HOCl.
- Хлористая кіслата HClO2.
- Хлорноватая кіслата HClO3.
- Хлоркавая кіслата HClO4.
- Бромноватистая кіслата HOBr.
- Бромноватая кіслата HBrO3.
- Бромная кіслата HBrO4.
- Иодноватистая кіслата HOI.
- Йодноватая кіслата HIO3.
- Метайодная кіслата HIO4, H5IO6.
У кожнай з гэтых кіслот пратон звязаны з атамам кіслароду, таму параўнанне даўжынь сувязяў пратонаў тут бескарысна. Дамінуючую ролю тут гуляе электраадмо. Актыўнасць кислотны ўзрастае з павелічэннем колькасці атамаў кіслароду, звязаны з цэнтральным атамам.
Знешні выгляд і стан рэчывы
Асноўныя фізічныя ўласцівасці галагенаў коратка можна выказаць у наступнай табліцы.
Стан рэчывы (пры пакаёвай тэмпературы) | Галаген | Знешні выгляд |
цвёрдае | ёд | фіялетавы |
астат | чорны | |
вадкае | бром | чырвона-карычневы |
газападобнае | фтор | бледна-жоўта-карычневы |
хлор | бледна-зялёны. |
Тлумачэнне знешняга выгляду
Колер галагенаў з'яўляецца вынікам паглынання бачнага святла малекуламі, што выклікае ўзбуджэнне электронаў. Фтор паглынае фіялетавы святло, і, такім чынам, выглядае светла-жоўтым. Ёд, наадварот, паглынае жоўты святло і выглядае фіялетавым (жоўты і фіялетавы – дапаўняюць колеру). Колер галагенаў становіцца цямней з ростам перыяду.
У закрытых ёмістасцях вадкі бром і цвёрды ёд знаходзяцца ў раўнавазе са сваімі парамі, якія можна назіраць у выглядзе каляровага газу.
Хоць колер астата невядомы, мяркуецца, што ён павінен быць цямней ёду (г. зн. чорным) у адпаведнасці з назіранай заканамернасцю.
Цяпер, калі вас папросяць: «Ахарактарызуйце фізічныя ўласцівасці галагенаў», вам будзе што сказаць.
Ступень акіслення галагенаў ў злучэннях
Ступень акіслення часта выкарыстоўваецца замест паняцці "валентнасць галагенаў". Як правіла, ступень акіслення роўная -1. Але калі галаген звязаны з кіслародам або іншым галагенавымі, ён можа прымаць іншыя стану: СА кіслароду -2 мае прыярытэт. У выпадку двух розных атамаў галаген, злучаных разам, больш электроотрицательный атам пераважае і прымае З -1.
Напрыклад, у хлориде ёду (ICl) хлор мае СА -1, і ёд +1. Хлор з'яўляецца больш электраадмо, чым ёд, таму яго СА роўная -1.
У бромная кіслаце (HBrO4) кісларод валодае СА -8 (-2 х 4 атама = -8). Вадарод мае агульную ступень акіслення +1. Складанне гэтых значэнняў дае СА -7. Так як канчатковае СА злучэння павінна быць нулявым, то З брому роўная +7.
Трэцім выключэннем з правіла з'яўляецца ступень акіслення галаген у элементарнай форме (X2), дзе яго СА роўная нулю.
Галаген | СА ў злучэннях |
фтор | -1 |
хлор | -1, +1, +3, +5, +7 |
бром | -1, +1, +3, +4, +5 |
ёд | -1, +1, +5, +7 |
астат | -1, +1, +3, +5, +7 |
Чаму СА фтору заўсёды -1?
Электраадмо павялічваецца з ростам перыяду. Таму фтор мае самую высокую электраадмо з усіх элементаў, што пацвярджаецца яго становішчам у перыядычнай табліцы. Яго электронная канфігурацыя 1s2 2s2 2p5. Калі фтор атрымлівае яшчэ адзін электрон, крайнія р-арбіталь цалкам запоўненыя і складаюць поўны актэт. Паколькі фтор мае высокую электраадмо, ён можа лёгка адабраць электрон у суседняга атама. Фтор ў гэтым выпадку изоэлектронен інэртным газе (з васьмю валентными электронамі), усе яго знешнія арбіталь запоўненыя. У такім стане фтор значна больш стабільны.
Атрыманне і прымяненне галагенаў
У прыродзе галагены знаходзяцца ў стане аніёнаў, таму свабодныя галагены атрымліваюць метадам акіслення шляхам электролізу або з дапамогай акісляльнікаў. Напрыклад, хлор выпрацоўваецца гідролізам раствора паваранай солі. Прымяненне галагенаў і іх злучэнняў па-рознаму.
- Фтор. Нягледзячы на тое, што фтор вельмі реактивен, ён выкарыстоўваецца ў многіх галінах прамысловасці. Напрыклад, ён з'яўляецца ключавым кампанентаў политетрафторэтилена (тефлона) і некаторых іншых фторполимеров. Хлорфторуглероды ўяўляюць сабой арганічныя хімічныя рэчывы, якія раней выкарыстоўваліся ў якасці холадагентаў і пропеллентов ў аэразолі. Іх прымяненне спынілася з-за магчымага іх ўздзеяння на навакольнае асяроддзе. Іх замянілі гидрохлорфторуглероды. Фтор дадаюць у зубную пасту (SnF2) і пітную ваду (NaF) для прадухілення разбурэння зубоў. Гэты галаген змяшчаецца ў гліне, якая выкарыстоўваецца для вытворчасці некаторых відаў керамікі (LiF), выкарыстоўваецца ў ядзернай энергетыцы (UF6), для атрымання антыбіётыка фторхинолона, алюмінія (Na3AlF6), для ізаляцыі высакавольтнага абсталявання (SF6).
- Хлор таксама знайшоў разнастайнае прымяненне. Ён выкарыстоўваецца для дэзінфекцыі пітной вады і плавальных басейнаў. Гипохлорит натрыю (NaClO) з'яўляецца асноўным кампанентам адбельвальнік. Саляная кіслата шырока выкарыстоўваецца ў прамысловасці і лабараторыях. Хлор прысутнічае ў поливинилхлориде (ПВХ) і іншых палімера, якія выкарыстоўваюцца для ізаляцыі праводкі, труб і электронікі. Акрамя таго, хлор апынуўся карысны і ў фармацэўтычнай прамысловасці. Лекавыя сродкі, якія змяшчаюць хлор, выкарыстоўваюцца для лячэння інфекцый, алергіі і дыябету. Нейтральная форма гідрахларыд – кампанент многіх прэпаратаў. Хлор выкарыстоўваецца таксама для стэрылізацыі бальнічнага абсталявання і дэзінфекцыі. У сельскай гаспадарцы хлор з'яўляецца кампанентам многіх камерцыйных пестыцыдаў: ДДТ (дихлородифенилтрихлорэтан) выкарыстоўваўся ў якасці сельскагаспадарчага інсектыцыду, але яго выкарыстанне было спынена.

- Бром, дзякуючы сваёй негорючесть, ўжываецца для падаўлення гарэння. Ён таксама ўтрымліваецца ў бромистом метиле, пестициде, які выкарыстоўваецца для захоўвання ўраджаю і падаўлення бактэрый. Аднак празмернае выкарыстанне бромістыя меціла было спынена з-за яго ўздзеяння на азонавы пласт. Бром ўжываюць пры вытворчасці бензіну, фотастужкі, вогнетушыцеляў, лекаў для лячэння пнеўманіі і хваробы Альцгеймера.
- Ёд гуляе важную ролю ў належным функцыянаванні шчытападобнай залозы. Калі арганізм не атрымлівае дастатковай колькасці ёду, адбываецца павелічэнне шчытападобнай залозы. Для прафілактыкі валля дадзены галаген дадаюць у павараную соль. Ёд таксама выкарыстоўваецца ў якасці антысептычнага сродкі. Ёд змяшчаецца ў растворах, якія выкарыстоўваюцца дляачысткі адкрытых ран, а таксама ў дэзінфікуюць спрэю. Акрамя таго, ёдыд срэбра мае важнае значэнне ў фатаграфіі.
- Астат – радыеактыўны і рэдказямельных галаген, таму яшчэ нідзе не выкарыстоўваецца. Тым не менш мяркуюць, што гэты элемент можа дапамагчы еду ў рэгуляцыі гармонаў шчытападобнай залозы.
Article in other languages:

Alin Trodden - аўтар артыкула, рэдактар
"Прывітанне, Я Алін Тродден. Я пішу тэксты, чытаю кнігі і шукаю ўражанні. І я нядрэнна ўмею распавядаць вам пра гэта. Я заўсёды рады ўдзельнічаць у цікавых праектах."
Навіны
Кіраванне Аляксея Міхайлавіча Тишайшего. Загад Таемных спраў
Ўстанова загада Таемных спраў (год фарміравання прыблізна 1653-й), ініцыяванае Аляксеем Міхайлавічам Найціхі, пераследвала дзве мэты. З аднаго боку, ён выкарыстоўваўся як індывідуальная канцылярыя гаспадара. З іншага - загад Таемн...
Есаул - гэта званне ў казачым войску
У – гэта чын у казачым войску. Спачатку так называўся памочнік ваеначальніка, пазней есаула сталі прыраўноўваць да ротмистру альбо капітану. Што азначае гэта слова?Этымалогія словаПа адной версіі, "есаул" – гэта слова ...
Таня Савічава: біяграфія, блакадны дзённік і цікавыя факты
Звычайная ленінградская дзяўчынка Таня Савічава стала вядомая на ўвесь свет дзякуючы сваім дзенніку, які яна вяла ў 1941 – 1942 гг. падчас блакады Ленінграда. Гэтая кніжачка стала адным з галоўных сімвалаў тых страшных падзе...
Прынцып парэта: змест і асновы прымянення
Фенаменальнае адкрыццё знакамітага італьянскага сацыёлага і эканаміста Вільфрэда Парэта было зроблена ў выніку аналізу размеркавання багаццяў у Італіі, у ходзе якога Парэта усталяваў, што ў краіне 80% усіх багаццяў належыць 20% на...
Цягліцавая сістэма і асноўныя групы цягліц
Цягліцавая сістэма ставіцца да адным з самых важных біялагічных падсістэм, з дапамогай якіх арганізм выконвае розныя руху. Яе можна прадставіць у выглядзе сукупнасці цягліцавых валокнаў, здольных да скарачэння. Валакна злучаюцца п...
Развіццё і росквіт Кіеўскай Русі
Кіеўская Русь – найбуйнейшае дзяржава сярэднявечнай Еўропы. Яно сфармавалася ў 9 стагоддзі ў выніку ўнутранага развіцця славянскіх плямёнаў. Кіеўская Русь адыграла значную ролю ў гісторыі ўсходнеславянскіх народаў. На працяг...





















Заўвага (0)
Гэтая артыкул не мае каментароў, будзьце першым!