Now - 15:35:42
酸化物、塩、塩基、酸. 特性酸化物、塩酸塩
現代化学は、幅広い分野で、それぞれの理論的枠組みの実践的価値、実用的です。 どんなタッチの周りに製品化。 の主要な部門無機-有機化学。 を考え、どのように本授業の物質に属する無機、どういう性質を有しているかについて.
主な種類の無機化合物
このと考えられる。
- 酸化物.
- 塩です。
- です。
- 酸性になります。
それぞれの授業に代表される様々な化合物の無機的自然として価値のほとんどの構造の経済-産業活動ではないでしょうか。 すべての特徴は、これらの化合物は、自然や留学コース化学は必須の成績8-11.
一般的にテーブルの酸化物、塩、塩酸、具体例をそれぞれの物質とその状態の集約されます。 とを示す相互作用を記述する化学物件です。 また、各クラスは別に、より詳細に説明します。

グループの化合物-酸化物
酸化物クラスの無機化合物からなる二つの要素のバイナリ)、常にO(酸素)が低い程度の酸化-2立第二の実験式の物質です。 例:N2O5,Caいます。
酸化物に分類されています。
S.ス中性的な形に挑みます。
。 塩を形成する。塩(拠点では、両化合物、酸).
- 酸注入すると水が酸化され 形成されるnonmetalsが金属の高度な酸化).
- 定水形成します。 成要素です。
- 複面の酸基本という二つの性質を決めるのは、反応条件を変えて明らかにした。 形成される遷移金属である。
- 複合多くの塩を形成して素子を複数の酸化です。
最酸化物は酸化物の形成要素の最大値の酸化の可能性が示唆された。 例:テ+6. のためのテルルの最大酸化状態に+6、TeO3が最も高い酸化物のこの要素になります。 周期表の下に各グループの署名の実験式を背景に、高い酸化物のためのすべての科目を合計したうえで、そこからグループがお届けいたしません。 例えば、最初のグループの要素(アルカリ金属)または式の形式でR2O、すべての要素のサブグループはこのグループにおいて同じ式にした。 例:Rb2O,Cs2Oです。
以上
人間の神経系としてのコーディネーターになります。 いろいろなものを発信コマンドからの脳の筋肉、臓器、組織、プロセスの信号が来ています。 どのようなデータの中の神経インパルス. 何ですか? スピードす。 これらの数に基づく総合的質疑応答えないことを示しています。う神経インパルス?という波の励起とスプレッドの繊維としての対応刺激の神経細胞となる。 このメカニズムが確実に情報伝達から各種受容体のきるようになりました。 そして、異なる臓器(筋肉や腺). どこのプロセスを表す生理はどうすればいいですか? ...
ピラミッドの中、この日は謎できます。 その謎のが一番いいと思います。 世界の存在を知りこれらのピラミッドです。 に20世紀絵画の奇跡でしたからとられます。 そして人類の知 このピラミッドが存在した。 今日でも、これらの宝物の世界の文化を厳重に保護されて政府はこの国です。ただし、ピラミッドの中国にとって大きな関心事項の多くの研究者と考古学者. 言い伝えでは、既存のがこの国のピラミッド、外国人の人が訪れています。 の正確な年齢のこれらの独自の構造を、誰もが知っています。 最初の情報について...
乱のDecembristsに1825–数のイベントに、我が国ることが知られているすべてます。 一般に、ウズベキスタンのほとんどの人が想像するこのイベントで何を終了しました。 多くの歴史学者に捧げてその活動の研究ではこの素晴らしい。すべてのDecembrist反乱が大きな影響を与えるのは、国家開発の一部のものが多いと感じている今日のイベントの結果何が起きたのか、元老院広場があります。[rek1]まず、その原因Decembrist乱. そして、もちろん、人を忘れて、戦争の18...
溶出性の高い酸化物、水または対応する水酸化物(あく、酸または複水酸化物).

特性の酸化物
酸化物に存在することはできすべての国の集計での通常の条件です。 その大半は固体結晶または粉末状(Cao,SiO2)には、一部(酸酸化物をしていることが明らかになったの液体(Mn2O7)は、ガスのない、2). これにより、安定した格子構造です。 この違いに沸点、融点が異なる代表者から-2720C+70-800C(もしております。 水への溶解性が異なります。
- 可溶性酸化物基礎金属、アルカリ金属、アルカリ土類金属、酸以外のシリコン酸化物としても活用できる。
- 不溶性複酸化物、その他の主SiO2.
どの酸化物との交流?
酸化物、塩、塩基、酸展類似物件です。 一般的性質のほぼすべての酸化物を除く中立の力の結果として一定の相互作用しながら、さまざまな塩。 しかし、各グループの酸化物の特徴とその特殊化学的性質、反射プロパティを持ちます。
1. 水との反応で形アルカリ(酸化物のアルカリ及びアルカリ土類金属)
Fr2O+水=2FrOH
2. 反応酸形成の塩水
酸+Me+nO=H2O+Sol
3. 反応と、塩と水
リチウム酸化物+酸化窒素(V)=2LiNO3
4. 反応する要素に変化
Me+nO+C=Me0+株
| 酸化物基礎-OO | 酸性の酸化物-KO | デュアル(複) 酸化物-JSC | 酸化物を形成せず塩 |
1. 試験用水の形成酸(SiO2の例外。 KO+水=酸 2. 反応拠点: CO2+2CsOH=Cs2CO3+H2O 3. 反応の基礎的な酸化物の形成塩 P2O5+3MnO=Mn3(PO3)2 4. 反応慶應義塾大学先端生命科学: CO2+2Ca=C+2CaO | 展示デュアル特性との原則に基づ酸基(酸、アルカリ、基本的な酸化物、酸性の酸化物)。 水との相互作用になります。 1. 酸との塩、水 AO+酸塩+N2O 2. と拠点(アルカリ)の形成hydroxocomplexes Al2O3+LiOH+水=Li[Al(OH)4] 3. 反応は酸性の酸化物を得る塩 FeO+2=FeSO3 4. との反応OOの形成の塩、溶 MnO+Rb2O=ダブル塩のRb2MnO2 5. の反応との融合アルカリおよび炭酸塩のアルカリ金属塩の教育 Al2O3+2LiOH=2LiAlO2+H2O | な形で酸やアルカリ. ショー特定のプロパティを持ちます。 |
それぞれの高い酸化物を形成して、金属、非金属が水に溶解する強酸やアルカリ性である。
酸有機-無機
にクラシック音の位置AL-電解離-Svanteのアレニウス)酸化合物の水生環境における離の陽イオンH+と陰イオン残基の酸る-. しかし、今日の子ども酸無水条件では多くの理論のための水酸化物.
実験式の酸化物、塩酸、塩のみ形成されて文字要素を示す指標の数物質です。 例えば、無機酸によるH+酸性残基N. 有機物質においても理論的に表示されます。 また、実証的なものに記述することができる全物構造式を反映していないのみの構成との分子数がの原子配列を、その関係をそれぞれの機能グループのカルボン酸-COOH.
Neorganika全ての酸きく二つに分かれています。
- 無酸素-HBr,、シアン化水素HCL、その他
- 酸素を含む(オキソ)-HClO3とある場所に酸素からなる。
または無機酸類による安定性(安定や安全を除き石炭、硫黄、不安定、不安定な炭素-硫黄). の強度の酸強い硫酸、塩酸,硝酸、過塩素、その他どの弱いhydrosulfuric、次亜塩素、その他であります。

この多様性有機化学。 酸、有機自然の中で、カルボン酸. 共通の特徴は、存在感の機能グループ-COOH. 例えば、HCOOH(蟻酸)、CH3COOH(酢)C17H35COOH(ステアリン)。
あ酸は、特に厳選を重点に検討本の学校コースhimii.
- Solana.
- Asuna.
- Ortofosfornoj.
- Bromomethane.
- Ogolna.
- Yodovidona.
- Serna.
- Ukusnaはatanova.
- ブタン、オイル。
- 安息香.
これら10回の酸化学の基礎的物質のそれぞれのクラスとしての学校コース、一般産業-合成

物性無機酸
主な物理的性質をきれず、異なる物理的状態です。 そもそも多くの酸を有する形態の結晶や粉(ホウ、リン酸で通常の条件です。 大多数の知の無機酸を表し、異なる液体です。 沸点、融点も異なります。
酸の原因重傷熱傷していく力、破壊の有機組織、皮膚などです。 検出のための酸を用指標:
- Methylorange(典型的な中酸オレンジ-赤色の場合)
- 試(中紫の酸赤)または一部です。
最も重要な化学的性質などとコミュニケーションするシンプルな複雑な物質です。
| うと | 例の対応 |
1. 単純な物質です。 前提条件:金属するEHRM水素の金属面した後に水素であり、なかに置き換えらている。 この反応は常に形式水素ガスや塩です。 | HCL+アル=アルミニウム塩化物+H2 |
2. のです。 の結果の反応は塩水です。 な反応の強酸と塩基と呼ばれる中和反応です。 | 酸(強)+瞬間base=塩水 |
| 3. との複水酸化物. その結果、塩水です。 | 2HNO2+水酸化物のベリリウム=Be(NO2)2(g中)+2H2O |
| 4. 基本的な酸化物である。 その結果、水、塩です。 | 2HCL+FeO=塩化鉄(II)+H2O |
| 5. との複酸化物とする。 最終的効果:塩水です。 | 2HI+ZnO=ZnI2+H2O |
6. 塩を形成の弱いている。 最終的効果:塩を弱酸性になります。 | 2HBr+MgCO3=マグネシウムブロミド+H2O+CO2 |
その相互作用の金属反応のないすべてのものです。 化学(9年生)が学校には浅い研究のような反応しかし、このレベルを扱う特定の性質の濃硝、硫酸との相互作用に対す。
水酸化物:アルカリ、両性、不溶性のベース
酸化物、塩、塩酸-すべてのこれらのクラス物質について共通の化学的特性により格子構造の相互の影響で、原子、分子構造。 ただし、酸化物を与える非常に具体的な定義の酸、塩基ので難いという特徴があります。
と同じ酸、塩基の理論編ている物質ができる水溶液中にディアに取り上げられて陽イオンの金属MeN+と陰イオンhydrocorpた-.
分の拠点は、以下を使います:
- 可溶性アルカリ(拠点の色が変化する指標. 形成される金属のI、II群です。 例:KOH、NaOH LiOHする要素を考慮しみの主なグループ);
- 若干溶性、不溶性の平均電力は変化する色の指標). 例:水酸化マグネシウム、鉄(II),(III)。
- 分子(弱ベース、水中可逆的解離イオン-分子). 例:N2H4,アミン、アンモニア.
- 複水酸化物(展示デュアル基礎-酸性のです。 例:水酸化アルミニウム、beryllia、亜鉛などです。

各グループでは留学コース化学の"背景"です。 8-9化学のクラスは詳細な研究は、アルカリ、溶化合物.
主な特徴的な性質を拠点
すべてのアルカリ、溶化合物が自然の固体結晶の状態です。 の融解温度を通常は低く、多少水溶性水酸化物の分解の場合の加熱を行います。 色の拠点が異なります。 場合はアルカリは白色の結晶を溶分子基盤できるので色が異なる特徴があります。 の溶解性の化合物は、このクラスを表示し式の酸化物、塩酸、塩、溶解度
アルカリ変更できるの色の指標は以下のように、phenolphthaleinマゼンタ、methylorange黄色となります。 ですから無償提供されているの存在hydrocorp溶けています。 そのため、溶ベースなどの反応はいません。
化学的性質の各グループの異なる。
| 化学的性質 | ||
| Alkalies | 低由 | 複水酸化物 |
Iとの交流を計-塩分、水道): 2LiOH+3=Li>2で4+水 。 と酸(塩水) 共通中和(酸) III. とAO教育hydroxocomplexの塩水 2NaOH+MeNO=Na2Me+nO2+H2O, Na2[Me+n(OH)4] IV. との複水酸化物形成の塩hydroxocomplex: もとの形でなく水 V.との交流溶性の塩を形成不溶性水酸化物、塩 3CsOH+塩化第二鉄(III)=Fe(OH)3+3CsCl VI. と亜鉛、アルミニウム水溶液中で形成と塩化水素 2RbOH+2Al+水=複水酸化物イオン2Rb[Al(OH)4]+3H2 | た場合は、できる分解: 不溶性水酸化=酸化水 。 反応酸(その結果、塩水) Fe(OH)2+2HBr=FeBr2+水 III. と。 Me+n(OH)N+RO=塩+H2O | S.スと反応し酸塩を形成させ、水 水酸化銅(II) +2HBr=CuBr2+水 。 に反応してアルカリの結果、塩水(条件:フュージョン) Zn(OH)2+2CsOH=塩+2H2O III. 反強い水酸化物aの塩の反応から水溶液: Cr(OH)3+3RbOH=Rb3[Cr(OH)6] |
大多数の化学的性質、マニフェストが基本となります。 化学科の理由は簡単であると認識しており一般の動向の全ての無機化合物.
クラスの無機塩。 分類物性
に頼の規定に塩でできる無機化合物の水溶液の電離から生ずるイオンの金属Me+nは、陰イオンの酸性残るN. できました。 のの定義は化学を与えませんが、これは、最も精密です。
化学的に自然塩で。
- 酸性(有するカチオンの水素). 例:NaHSO4.
- 核るhidrocloruro). 例:MgOHNO3、FeOHCL2.
- 中(のみで陽イオンは、金属酸残基). 例:NaCL,ーcaso4.
- ダブル(二つの異なる金属イオン). 例:NaAl(い4)3.
- 複合hydroxocomplexes,aquacomplexができる。 例:2[Fe(CN)4].
塩分式反映される化学は、自然がもつ定性的、定量的組成物を得る事ができます
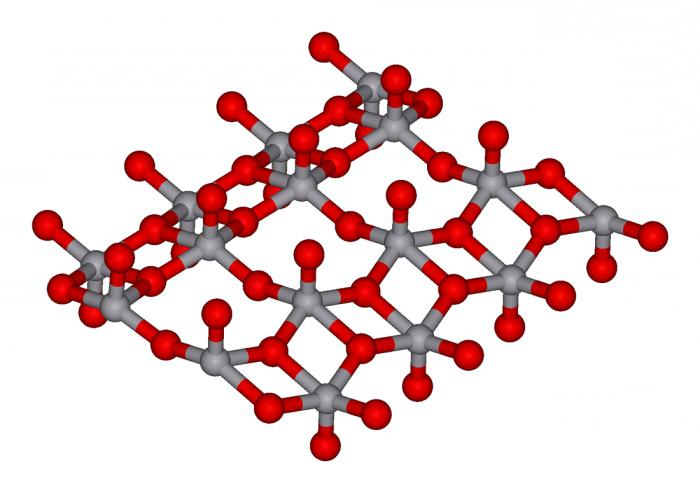
酸化物、塩、塩酸が異なる能力を溶性を見ることができるのに対応します。
という話での集合状態の塩、その語. てのみ存在する固体結晶または粉状態です。 色の範囲は多岐にわたります。 解錯塩としてが明るい飽和した色をします。
化学的相互作用のためのクラスの中塩
と同等の化学的性質の塩酸塩。 の酸化物として見つか用意しています。
の合計が4種類の主要な二次的相互作用の解明に挑みます。
I相互作用と酸のみの利編)"の形成は別の塩の弱酸性:
KCNS+HCL=KCL+HCNS
。 反応性可溶性の水酸化物の外観は不溶性の塩ならびに拠点:
CuSO4+2LiOH=2LiSO4塩水溶性+Cu(OH)2溶ベース
III. 他の溶性の塩を形成不溶性の塩溶性:
PbCL2+Na2S=PbS+2NaCL
IV. と反応して金属に立EHRM左る塩を形成する. このように、反応性金属は通常と水
Mg+2AgCL=MgCL2+2Ag
これらの種間相互作用の特徴である中塩。 式の複雑な塩基本的な、ダブル、サワーなどがこれを雄弁に物語っている人の特異性を示すように、化学プロパティを持ちます。

公式の酸化物、塩酸塩の化学的性質のすべての代表者のこれらのクラスの無機化合物、または、名前の物質とその物性を有します。 そのため、ライティングが支払うべき特別注目です。 多種多様な化合物は全体としては驚きの科学-化学 酸化物、塩酸、塩分の広大な多様性です。
Article in other languages:

Alin Trodden - 記事の著者、編集者
"こんにちはっAlin踏. 私はテキストを書いたり、本を読んだり、印象を探したりしています。 そして、私はそれについてあなたに伝えることで悪くないです。 私はいつも面白いプロジェクトに参加することができて幸せです."
関連ニュース
現代生活の組織化するインフラ整備は複数のコンポーネントの異なるテクノ機能な物件です。 このようなします。 平均の消費者が見た感じとして行って課題が最終的には次のように非常に顕著なのに家電製品、だけではありません。 このように、に関する質問に対しての電力は、多くのユーザーの同世帯の家電製品謎に満ちています。 増加の知見は、コスト力しています。[rek1]締結にあたってすべての時間の存在のエネルギー産業を受けます。 最近、新しい変化により、積極的な展開するオル...
化学的性質のエチレングリコールが特徴です。 Diatomicルアルコールになります。 エステルのエチレングリコール
最も知られるよび使用人の生命、産業の物質に属するカテゴリーの多価アルコール–エチレングリコール、グリセリン. その探査及び利用開始の数世紀前のものの性質のこれらの有機化合物は独自の独自の限り避けて頂き、少なくとも不可欠です。 多価アルコールの使用多くの化学合成の産業界の人間活動です。第“知”エチレングリコール、グリセロール:お支払い履歴1859年を通じて、二段階のプロセスの相互作用のdibromoethane銀酢酸および...
-分類生物学の研究の種多様性です。 の主要な業務などの分類-同定す.-分類植物の開発研究. 最初の研究者の分類を行ったTheophrastus. 代ハーブ、シュラブ、ブッシュします。 その後の研究を実施したルネサンス 当時、アルバートの気づきとの違いを広葉とmonocotyledonousます。 最初に分類され1583年. 系統分類に関する研究、植物によって作成されたイタリアCesalpinoたのTheophrastusおよび補足に基づく特性、構造物の果実...
非常に多くの生徒の7-9授業の中等学校は、課題作文を書の言語です。 何のその。 の課題は、どのように教える学生を策定し自分の考えます。 その目的は、も増加身の文法を改善する機能を利用スペルルールにロシアの言語です。 文-引数の言語が話題を受けて高得点できるように特定のアルゴリズムに基づいて明確に要求します。 について詳細に説明をします。 テキストにもたらされた課題のための言語小論文のヤー(2014). との差の二つの学問分野となっているのは文法よりも広い範...
かったアレクサンダー2? その人の天皇である。 略歴、年間の世
初日の春の1881た下し、血液中の天皇陛下に、ロシアとしてExplorerの改革が正しく作成される人を形容革命機ヴァルヴレイヴ. この日、皇帝アレクサンダー2(神-1855-1881)より殺害された原爆によってスローされるNarodnaya Volya Ignatius Grinevitsky.初期の代皇17APR1818モスクワでは、波長掃引のサンダーの花火–からお泊りのビショップハウスの帝国カップルが生まれた代の王座を受けての聖霊の名アレク...
の特性を文字です。 "のガーネットのブレスレット"Kuprin
主人公の物語“のガーネットのブレスレット”–の動画いたします。 の原稿の本作は泣いたします。 Kuprin明であるのかのすべての彼が作成されます。 特徴文字(‘ガーネットのブレスレット”)–対象になります。信仰の文字の配偶者のセーヌ河. すべりの特徴は、文字(‘ガーネットのブレスレット”)で与えられますので非常に不均一になります。 Kuprinかったのではないと...





















コメント (0)
この記事にはコメントすることですが、最初の!