Now - 15:08:36
Оксидтер, негіздер, тұздар, қышқылдар. Қасиеттері, оксидтер, негіздер, қышқыл, тұздар
Қазіргі заманғы химия ғылымы білдіреді көптеген әр түрлі салаларын, олардың әрқайсысы басқа, теориялық базаны, үлкен қолданбалы маңызы, практикалық. Содан бірде-коснись, барлық шеңбері бойынша - азық-түлік химиялық өндіріс. Басты бөлімдері - бейорганикалық және органикалық химия. Қарастырайық, қандай негізгі кластары заттарды жатқызады неорганическим және қандай қасиеттерге ие.
Басты санат бейорганикалық қосылыстардың
осындайларға қабылданды жатқызуға мынадай:
- Оксидтері.
- Тұз.
- Негіздер.
- Қышқылдар.
Әрбір сынып ұсынылды әртүрлілігімен қосылыстар бейорганикалық табиғат және мәні іс жүзінде кез келген құрылымындағы шаруашылық және өнеркәсіптік қызмет. Барлық негізгі қасиеттері, тән осы қосылыстардың табиғатта кездесуі және алу оқытылады курсында химия, міндетті түрде, 8-11 сыныптарда.
Бар жалпы кестесі оксидтері, тұздар, негіздер, қышқылдар, мұнда мысалдар әрбір заттар мен олардың агрегаттық күйін, табиғатта таралуы. Сондай-ақ көрсетілді өзара іс-қимылды сипаттайтын химиялық қасиеттері. Алайда, біз қараймыз сыныптарының әрқайсысы жеке-жеке және егжей-тегжейлі.

Топ қосылыстары - оксидтер
Оксиді - бұл сынып бейорганикалық қосылыстардың тұрған екі элементтен (бинарлық), олардың біреуі әрқашан Туралы (оттегі) төменгі тотығу дәрежесі -2 тұрған екінші орында эмпирикалық формула заттар. Мысал: N2О5, СаО және т.
Оксидтері былайша жіктеледі.
I. Несолеобразующие - қабілетті құруға тұздары.
ІІ. Солеобразующие - қабілетті құруға тұздары (негіз, амфотерными қосындыларымен, бір-бірімен қышқылдары).
- Қышқылды - түскенде суды құрайды қышқылы. Құрылды неметаллами көбінесе не металдармен жоғары (тотығу дәрежесі).
- Негізгі түскенде суды құрайды негіздері. Құрылды элементтер-металдар.
- Амфотерные - танытады қышқылдық-негізгі екі есе табиғатты, ол шарттарымен анықталады реакция. Құрылды өтпелі металдармен.
- Аралас - жиі жатады солям және құрылды элементтері бірнеше тотығу дәрежелері.
Жоғары тотығы - тотығы, онда құратын элементі орналасқан ең жоғары тотығу дәрежесі. Мысалы: Te+6. теллур ең жоғары тотығу дәрежесі +6, демек TeO3 - жоғары оксиді бұл элемент үшін. Периодтық жүйеде әр топ элементтерінің қол қоюы жалпы эмпирикалық формуласы көрсететін, жоғары оксиді үшін барлық элементтердің бұл топ, бірақ тек негізгі топта. Мысалы, бірінші топ элементтері (сілтілік металдар) тұр түрінің формуласы R2O, бұл білдіреді, бұл барлық элементтері басты ішкі топтың осы топта болады осындай формуланы жоғары оксиді. Мысалы: Rb2, Cs2O және т.
Көп:
Динамикалық және статикалық жұмыс бұлшық: айырмашылығы неде?
Динамикалық және статикалық жұмыс бұлшық үшін қажетті қалыпты жұмыс істеуі адам ағзасының орындау қозғалыстардың тән біздің телу. Адам ағзасы табиғатпен жасап шығарылды болатындай өте жақсы жеңе екеуімен де түрлері жүктеме. Динамикалық және статикалы...
Медицина колледжі медицина институтының қаласында Белгород жыл сайын қабылдайды, өзінің қанатының астына жүздеген студент облыс және жақын өңірлердің және жыл сайын шығарады мамандар орта медициналық білімі бар.қандай мамандықтар дайындайды мекемесі,...
Нервтік импульс, оның түрлендіру және беру тетігі
Жүйке жүйесі адам ретінде өзіндік үйлестірушісі біздің ағзамызда. Ол деп хабарлайды команданың ми мускулатуре, органдарға, тіндерге және өңдейді сигналдар шыққан олардан. Ретінде өзіндік тасығыштың деректер пайдаланылады жүйке серпін. Ол нені білдіре...
еріту Кезінде жоғары оксидінің судағы біз аламыз, тиісті гидроксиді (сілті, қышқыл немесе амфотерный гидроксиді).

Сипаттамасы оксидтерінің
Оксидтері қабілетті болды барлық агрегаттық күйде әдеттегі жағдайында. Олардың көпшілігі орналасқан қатты кристаллическом немесе ұнтақ түрінде (СаО SiO2), кейбір КО (қышқылды оксидтер) кездеседі түріндегі сұйықтықтар (Mn2O7), сондай-ақ газдар (NO, NO2). Бұл түсіндіріледі құрылымы кристалдық торлар. Осыдан айырмашылық температура қайнау және балқу, олар əр түрлі өкілдерінің -2720С-ден +70-800С (кейде одан жоғары). Суда ерігіштігі әр түрлі.
- Еритін - негізгі оксидтері металдар деп аталатын сілтілік, щелочноземельными, және барлық қышқылды, басқа кремний оксидінің (IV).
- Ерімейтін - амфотерные оксидтері, қалған барлық негізгі және SiO2.
бір оксидтері өзара іс-қимыл жасайды?
Оксидтер, тұздар, негіздер, қышқылдар танытады ұқсас қасиеттері. Жалпы қасиеттері барлық оксидтерінің (бұдан несолеобразующих) - бұл қабілеті нәтижесінде белгілі бір өзара құруға әр түрлі тұздары. Алайда әрбір топ үшін оксидтерінің тән өзінің ерекше химиялық сипаттамалары, көрсететін қасиеттері.
| Негізгі оксидтері - ОО | Қышқылды оксидтер - ҚО | Двойственные (амфотерные) оксидтер - АҚ | Оксидтері, түзетін тұздардың |
1. Реакция сумен білім сілтілер (оксидтері, сілтілі және сілтіліжер металдар) Fr2O + су = 2FrOH 2. Реакция қышқылдары: білім тұздар мен су. қышқыл + Me+nO = H2O + тұз 3. Реакция КО, білім тұздар мен су. оксиді литий + азот оксиді (V) = 2LiNO3 4. Реакция нәтижесінде элементтерін өзгертеді Me - +nO + C = Me0 + CO | 1. Реагент су: білім қышқылдар (SiO2 алып тастау) КО + су = қышқыл, 2. Реакция негіз: CO2 + 2CsOH = Cs2CO3 + H2O 3. Реакцияның негізгі оксидами: білімі тұздары, P2O5 + 3MnO = Mn3(PO3)2 4. Реакция ДМШ: CO2 + 2Ca = C + 2CaO, | Танытады қос қасиеттері, өзара іс-қимыл принципі бойынша қышқылдық-негіздік әдісінің (қышқылдармен, сілтілермен, негізгі оксидами, қышқылды оксидами). Сумен өзара іс-қимыл емес күшіне енеді. 1. Қышқылдармен: білім тұздар мен су. АҚ + қышқыл = тұз + Н2 2. Снегіздер (сілтілер): білім беру гидроксокомплексов Al2O3 + LiOH + су = Li[Al(OH)4]. 3. Реакция қышқылды оксидами алу тұздардың FeO + SO2 = FeSO3 4. Реакция ҚБ: білім тұздар, сплавление MnO + Rb2O = қос тұз Rb2MnO2 5. Реакция балқыту отырып, сілтілермен және карбонатами сілтілі металдар: білім тұздардың Al2O3 + 2LiOH = 2LiAlO2 + H2O | құрмаса бірде қышқыл, бірде сілті. Танытады тар ерекше қасиеттері. |
Әрбір жоғары оксиді, құрылған ретінде, металмен, сондай-ақ неметаллом, растворяясь суда береді күшті қышқыл немесе сілті.
Қышқылының органикалық және органикалық емес
классикалық звучании (негізге ала отырып, позицияларында ЭД - электролиттік диссоциациялану - Сванте Аррениуса) қышқылы - бұл қосылыстар сулы ортада диссоциирующие арналған катиондар Н+ және аниондар қалдықтарын қышқылы An-. Алайда бүгін мұқият зерттелді қышқылы және шөлейт жағдайларда, сондықтан көптеген әр түрлі теориялар үшін гидроксидов.
Эмпирикалық формулалар оксидтер, негіздер, қышқылдар, тұздар жинақталады тек рәміздерді, элементтердің индекстерін көрсететін олардың саны заттағы. Мысалы, бейорганикалық қышқыл көрінеді формуласы-H+ қышқыл қалдығы N-. Органикалық заттар бар басқа да теориялық бейнеленуі. Басқа эмпирикалық, олар үшін жазуға болады толық және қысқартылған құрылымдық формуласы, ол көрсетуі ғана емес, құрамы мен саны молекулалар мен атомдардың орналасу тәртібі, олардың арасындағы байланыс және басты функционалдық тобы үшін карбоновых қышқыл -СООН.
неорганике барлық қышқылдар екі топқа бөлінеді:
- бескислородные - HBr, HCN, HCL және басқа;
- кислородсодержащие (оксокислоты) - HClO3 және барлық бар оттегі.
Сондай-ақ органикалық емес қышқылдар жіктеледі тұрақтылығы (тұрақты немесе тұрақты - барлық басқа, көмір және күкірт, тұрақсыз немесе тұрақсыз - көмір және күкіртті). Күші бойынша қышқылының болуы мүмкін күшті күкірт, тұз, азот, хлор және басқа да, сондай-ақ әлсіз: сероводородная, хлорноватистая және т.

емес, осындай алуан ұсынады органикалық химия. Қышқылы бар органикалық табиғатқа жатады карбоновым қышқылдарға. Олардың жалпы ерекшелігі - болуы функционалдық топ -СООН. Мысалы, НСООН (құмырсқа), СН3СООН (сірке), С17Н35СООН (стеарин) және басқалар.
бірнеше қышқылдар, әсіресе мұқият баса назар аударылады қарау кезінде осы тақырыпты курсында химии.
- Соляная.
- Азотная.
- Ортофосфорная.
- Бромоводородная.
- Угольная.
- Иодоводородная.
- Серная.
- Уксусная немесе этановая.
- Бутан, немесе май.
- бензой қышқылы.
Деректер 10 қышқылдарының химия негіз болып табылады заттармен тиісті сынып ретінде курсында, сонымен қатар тұтастай алғанда өнеркәсіп және синтезах.

Қасиеттері қышқылдардың
негізгі физикалық қасиеттері нужно отнести бірінші кезекте, әр түрлі агрегаттық жай-күйі. Өйткені, бірқатар қышқылдар бар түрі кристалдар немесе ұнтақтарды (бор, фосфор) әдеттегі жағдайында. Басым көпшілігі сол белгілі қышқылдардың білдіреді әр түрлі сұйықтықтар. Температура қайнау және балқу, сондай-ақ өзгеріп тұрады.
Қышқылының қабілетті тудыруы ауыр күйіктер, өйткені ие күшпен бұзу органикалық мата және тері қабаты. Табу үшін қышқылдарды пайдаланады индикаторлар:
- метилоранж (әдеттегі ортада - сары, қышқылдар - қызыл),
- лакмус (бейтарап - күлгін, қышқылдар - қызыл) немесе кейбір басқа.
маңызды химиялық қасиеттеріне мыналарды жатқызуға болады қабілеті кіруге өзара іс-қимыл ретінде қарапайым және күрделі заттармен.
| бір өзара іс-қимыл жасайды | Мысал реакция |
1. Жай заттар-металдар. Міндетті шарт: металл тұрмауы керек ЭХРНМ дейін сутегі, өйткені металдар, тұрған соң, сутегі қабілетті емес, вытеснить оның құрамынан қышқыл. Нәтижесінде реакция әрқашан құрылады сутегі газ түрінде және тұз. | HCL + AL = алюминий хлориді + H2 |
2. Негіз. Қорытындысы реакция болып табылады тұз және су. Мұндай реакциялар күшті қышқылдар отырып сілтілермен киеді атауы реакциялардың бейтараптандыру. | Кез келген қышқылы (қатты) + ерітілетін негіз = тұз және су. |
| 3. С амфотерными гидроксидами. Қорытынды: тұз және су. | 2HNO2 + бериллий гидроксиді = Be(NO2)2 (орта тұз) + 2H2O |
| 4. Негізгі оксидами. Қорытынды: су, тұз. | 2HCL + FeO = темір хлориді (II) + H2O |
| 5. С амфотерными оксидами. Қорытынды нәтиже: тұз және су. | 2HI + ZnO = ZnI2 + H2O |
6. Тұздармен, білімді неғұрлым әлсіз қышқылдар. Қорытынды нәтиже: тұз және әлсіз қышқыл. | 2HBr + MgCO3 = бромид магний + H2O + CO2 |
өзара іс-қимыл Кезінде металдармен бірдей жауап берсе, барлық қышқылдар. Химия (9 сынып) мектеп болжайды өте неглубокое зерттеу мұндай реакциялар, бірақ мұндай деңгейде қаралады ерекше қасиеттері, азот және күкірт қышқылының өзара іс-қимыл кезінде металдармен.
Гидроксидтері: сілтілер, амфотерные және ерімейтін негіздер
Оксидтер, негіздер, тұздар, қышқылдар, барлық сыныптарзаттардың ортақ химиялық табиғатын, объясняющуюся құрылымы кристалдық торлар, сондай-ақ өзара әсерімен атомдардың құрамындағы молекулалардың. Алайда, егер оксидтерінің болатын беруге әбден нақты анықтау, яғни қышқылдар мен негіздердің мұны істеу қиындау.
сол сияқты, қышқылдар, негіздер теориясы бойынша ПҚ деп аталады қабілетті заттар су ерітіндісінде распадаться арналған катиондар металл ХбN+ және аниондар гидроксогрупп ОЛ-.
санатқа Бөлу негіздері төмендегідей:
- Еритін немесе сілті (күшті негіздер, түсін өзгертетін индикатор). Құрылды металдармен I, II топ. Мысалы: КОН, NaOH, LiOH (яғни ескеріледі элементтері тек негізгі топшалардың);
- Малорастворимые немесе ерімейтін (орта күші, түсін өзгертетін индикатор). Мысалы: магний гидроксиді, темір (ІІ), (ІІІ) және т.
- Молекулалық (әлсіз негіздері, сулы ортада обратимо диссоциируют арналған иондары-молекулалар). Мысал: N2H4, аминдер, аммиак.
- Амфотерные гидроксидтері (танытады двойственные основно-қышқылды қасиеттері). Мысалы: алюминий гидроксиді, берилия, мырыш және т.

Әрбір ұсынылған тобы оқытылады курсында химия "бөлімінде Негіздері". Химия 8-9 сынып оқушылары білдіреді егжей-тегжейлі зерделеу, сілтілердің және малорастворимых қосылыстар.
Басты тән қасиеттері негіздердің
Барлық сілтілер және малорастворимые қосылыстар, олар табиғатта қатты кристаллическом жай-күйі. Бұл ретте, балқу температурасын және олардың, әдетте, невысоки және малорастворимые гидроксидтері разлагаются қыздырғанда. Түсі негіздер әртүрлі. Егер сілті ақ түсті болса, онда кристалдар малорастворимых және молекулалық негіздер болуы мүмкін ең әр түрлі бояу. Ерігіштігі көптеген қосылыстардың осы сынып кез-кестеде көрсетілген формулалар оксидтер, негіздер, қышқылдар, тұздар, көрсетілген олардың ерігіштігі.
Сілтілер қабілетті өзгертуге болады индикаторлары келесідей: фенолфталеин - қызыл күрең, метилоранж - сары. Бұл қамтамасыз етіледі еркін қатысуымен гидроксогрупп ерітіндісінде. Сондықтан малорастворимые негіздері мұндай реакция бермейді.
Химиялық қасиеттері әр топ әр түрлі негіздер.
| Химиялық қасиеттері | ||
| Сілтілер | Малорастворимых негіз | Амфотерных гидроксидов |
I. Өзара іс-қимыл жасайды КО (қорытынды тұз және су): 2LiOH + SO3 = Li2SO4 + су, ІІ. Өзара іс-қимыл қышқылдар (тұз және су): қарапайым реакциясын бейтараптандыру (қараңыз қышқылы) ІІІ. Өзара іс-қимыл жасайды АҚ білімі бар гидроксокомплекса тұз және су: 2NaOH + Me+n O = Na2Me - +n O2 + H2O, немесе Na2[Me+n (OH)4]. IV. Өзара іс-қимыл жасайды амфотерными гидроксидами білімі бар гидроксокомплексных тұздар: дәл және АҚ, тек сусыз V. Өзара іс-қимыл жасайды растворимыми тұздарымен білімі бар ерімейтін гидроксидов және тұздар: 3CsOH + темір хлориді (III) = Fe(OH)3 + 3CsCl VI. Өзара іс-қимыл жасайды мырышпен және алюминиймен су ерітіндісінде білімі бар тұздар және сутегі: 2RbOH + 2Al + су = кешен гидроксиді ионом 2Rb[Al(OH)4] + 3H2 | I. қыздырғанда қабілетті разлагаться: нерастворимый гидроксиді = оксиді + су, ІІ. Реакция қышқылдары (нәтижесі: тұз және су): Fe(OH)2 + 2HBr = FeBr2 + су, ІІІ. Өзара іс-қимыл жасайды КО: Me - +n (OH)N + КО = тұз + H2O | I. Жауап берсе, қышқылдармен білімі бар тұз және су: мыс Гидроксиді (II) + 2HBr = CuBr2 + су, ІІ. Көңіл бөле отырып сілтілермен: итог - тұз және су (шарты: сплавление) Zn(OH)2 + 2CsOH = тұз + 2H2O ІІІ. Жауап берсе, күшті гидроксидами: итог - тұз, егер реакция жүріп су ерітіндісінде: Cr(OH)3 + 3RbOH = Rb3[Cr(OH)6]. |
Бұл көптеген химиялық қасиеттері, олар танытады негіздері. Химия негіздер жеткілікті қарапайым және жалпы заңдылықтарына бағынады барлық бейорганикалық қосылыстар.
Сынып бейорганикалық тұздар. Классификациясы, физикалық қасиеттері
ережелеріне сүйене отырып, ЭД тұздарымен деп атауға болады органикалық емес қосылыстар су ерітіндісінде диссоциирующие арналған катиондар металл Хб+n және аниондар қышқыл қалдықтарының AnN-. Осылай ұсынуға болады тұздары. Анықтау химия береді емес, бір, бірақ бұл неғұрлым дәл.
бұл Ретте өзінің химиялық табиғаты барлық тұздары бөлінеді:
- Қышқыл (бар құрамында катион сутегі). Мысалы: NaHSO4.
- Негізгі (бар құрамында гидроксогруппу). Мысалы: MgOHNO3, FeOHCL2.
- Орташа (ғана тұрады катиона металдың және қышқыл қалдығының). Мысалы: NaCL, CaSO4.
- Қос (қамтиды екі түрлі катиона металл). Мысалы: NaAl(SO4)3.
- Кешенді (гидроксокомплексы, аквакомплексы және басқа да). Мысалы:2[Fe(CN)4].
тұздардың Формуласын көрсетеді, олардың химиялық табиғатын, сондай-ақ туралы айтады сапалық және сандық құрамындағы молекулалар.
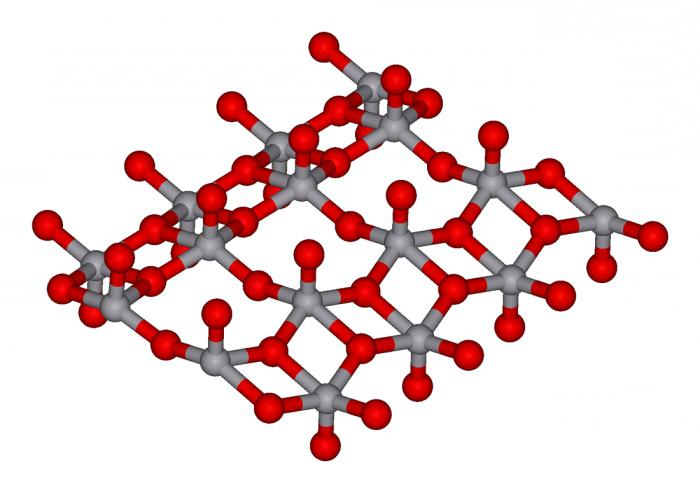
Оксидтер, тұздар, негіздер, қышқылдар ие әр түрлі қабілетімен ерігіштік көруге болады тиісті кестесінде.
Егер туралы айту агрегаттық күйдегі тұздар болса, айта оларды однообразие. Олар тек қатты, кристаллическом немесе ұнтақ күйінде. Түс гамма жеткілікті әр түрлі. Ерітінділер, комплексті тұздардың, ереже бойынша, бар жарқын қанық бояулар.
Химиялық өзара іс-қимыл үшін сынып орта тұздар
ұқсас химиялық қасиеттері, негіздер, қышқылдар, тұздар. Оксидтер, біз қарастырып, бірнеше ерекшеленеді, олардың осы фактор.
Барлығы бөлуге болады негізгі 4 типті өзара қарым-орта тұздар.
I. Өзара іс-қимыл қышқылдар (тек күшті тұрғысынан ЭД) білімі бар басқа тұздары мен әлсіз қышқыл:
KCNS + HCL = KCL + HCNS
ІІ. Реакция растворимыми гидроксидами пайда болуымен тұз және ерімейтін негіз:
CuSO4 + 2LiOH = 2LiSO4 тұз растворимая + Cu(OH)2 нерастворимое негізі
ІІІ. Өзара іс-қимыл басқа растворимой тұз білімі бар нерастворимой тұздары және растворимой:
PbCL2 + Na2S = PbS + 2NaCL
IV. Реакция металдармен тұрған " ЭХРНМ солға қарай қатар тұз түзеді. Бұл ретте енетін реакция металл емес әдеттегі жағдайында кіруге өзара іс-қимыл сумен:
Mg + 2AgCL = MgCL2 + 2Ag
Бұл негізгі түрлері өзара тән орта тұздар. Формулалар тұздар кешенді, негізгі, қосарланған және қышқыл өздері туралы айтады ерекшелігін проявляемых химиялық қасиеттері.

Формула тотықтардың, негіздердің, қышқылдардың, тұздардың химиялық мәнін көрсетеді барлық өкілдерінің деректерді сынып бейорганикалық қосылыстар, сонымен қатар, туралы түсінік береді атауындағы заттар мен оның жеке қасиеттері. Сондықтан оларды жазу қажет ерекше назар. Үлкен алуан қосылыстар бізге ұсынады тұтастай алғанда, таңғажайып ғылым " - химия. Оксидтер, негіздер, қышқылдар, тұздар) - бұл необъятного алуан.
Article in other languages:

Alin Trodden - мақала авторы, редактор
"Сәлем, Мен Алин Тродденмін. Мен мәтіндер жазып, кітаптар оқып, әсер іздеймін. Мен сізге бұл туралы айтуды жақсы білемін. Мен әрқашан қызықты жобаларға қатысқаныма қуаныштымын."
Жаңалықтар
Бұл қара материя ма? Ма темная материя ма?
Сұрақ шығарылған Ғаламның, оның өткен және болашақ волновал адамдар ерте заманнан бері. Көптеген ғасырлар бойы теория туындады және опровергались ұсына отырып, әлем бейнесін, сүйенген "хезбаллах" белгілі деректер. Основательным по...
Химиялық қасиеттері этиленгликоль, сипаттамасы. Двухатомный спирт. Этиленгликоль эфирлер
Ең танымал және қолданылатын адам өміріндегі және өнеркәсіп заттар тиесілі санаты көпатомды спирттердің « бұл этиленгликоль және глицерин. Оларды зерттеу және пайдалану басталды, бірнеше ғасырлар бұрын, бірақ қасиеттері осы ...
Ұқсастықтары мен айырмашылықтары, адам мен жануарлар - өте қызықты тақырып. Кейін Ч. Дарвин қалыптастырған, өз эволюционную теориясын басталды нескончаемые жөніндегі даулар, сонымен қатар, шын мәнінде қандай адамдар произошли от м...
Қандай Александр 2? Жеке басын куәландыратын император. Өмірбаяны, жылдар басқарма
наурыз 1881 жылғы обагрен қанмен императордың кірген тарихын Ресей сияқты ұлы жолсерік реформаны құқық бойынша заслужившего дарованный оған халық эпитет освободителя. Бұл император Александр 2 (годы правления - 1855-1881) өлтірілд...
Сипаттамасы батырлар. "Гранатовый браслет" Куприна
Батыр повесі «Анар білезік» – ең жүрекке жылы тиетін жарқын бейнелерді әдебиетте. Қолжазба осы туындының жылаған автор өзі. Куприн бермегенін, ол болып табылады ең целомудренным барлық сонымен қатар, ол құрды. Си...
Жартылай өткізгішті лазерлер: түрлері, құрылысы, жұмыс істеу принципі, қолдану
Жартылай өткізгіш лазерлер болып табылады квантовыми генератор негізінде жартылай өткізгіш белсенді ортаны оптикалық күшейту құрылады амалсыз сәуле кезінде квантовом арасында ауысу энергетикалық деңгейлері кезінде үлкен концентрац...





















Комментарий (0)
Бұл мақала емес, түсіндірмелер, бірінші болыңыз!