Now - 19:45:49
Formülü oksijen. Periyodik tablo Periyodik - oksijen
Kimyasal element oksijen ise ikinci dönem VI-aman ana grup eski kısa seçenek periyodik tablo. Yeni standartlar numaralandırma — 16-ben bir grup. İlgili karar IUPAC 1988 yılında. Formülü oksijen gibi basit bir madde —2. Düşünün onun temel özellikleri, rol, doğada ve tarım. Öncelikle özellikleri tüm grup periyodik sistem, başkanlığında bir oksijen. Öğe farklıdır akraba ona халькогенов ve su farklı hidrojen sülfür bileşikleri, selenyum ve tellür. Açıklama tüm ayırt edici özelliklerine bulunabilir, sadece öğrenme yapısı ve özellikleri atom.
Халькогены — ilgili oksijen öğeleri
Benzer özelliklerine göre atomu oluşturan bir grup periyodik sistem. Oksijen kafa ailesi халькогенов, ama onlardan farklı bir dizi özellikleri.
Atomik kütle oksijen — родоначальника grubu — ise 16. e. m. Халькогены oluşumunda bileşikler, hidrojen ve metaller sergilemek, kendi örf ve oksidasyon derecesi: –2. Örneğin, bileşiminde su (N2O) oksidatif sayısı, oksijen eşittir –2.
Kompozisyon tipik hidrojen bileşikleri халькогенов sorumlu genel formülü H2R. çözülerek bu maddelerin oluşturduğu asit. Sadece hidrojen bileşik oksijen — su — özel niteliklere sahip. Sonuçlara göre bilim adamları, bu alışılmadık maddedir ve çok zayıf bir asit, çok zayıf bir temel.
Kükürt, selenyum ve tellür var tipik bir pozitif oksidasyon derecesi (+4, +6) bileşikleri ile oksijen ve diğer неметаллами sahip yüksek электроотрицательностью (EO). Bileşimi oksit халькогенов yansıtan genel bir formül: RO2 RO3. Karşılık gelen asit var kompozisyon: H2RO3, H2RO4.
Daha:
Sinir impuls, onu dönüştürme ve aktarım mekanizması
Sinir sistemi savunan bir tür koordinatörü vücudumuzda. O komutları iletir beyin мускулатуре, organlara, dokulara ve işler sinyalleri gidiyor onlara. Tür olarak veri taşıyıcı tarafından kullanılan bir sinir dürtü. Neyi temsil ettiğini? Hangi hızda ça...
Isıl işlem çelik yapılabilir çeşitli yolları vardır. Uzmanlar ayırt aşağıdaki seçenekleri sunar: 1. Ateş. 2. Normalleştirme. 3. Sertleşme olduğunu. 4. Tatil. Isıl işlem çelik kızartma temsil ısıtma ürün sıcaklık 840 900 derece. Sırasında belirtilen s...
Ana tür duyumlar: sınıflandırma, özellikleri
Psikoloji – bu çalışmalar bilim farklı zihinsel süreçler, olaylar ve durum. Bu bilgilendirici zihinsel süreçleri içerir hissi, görünüm, algı, hayal gücü, konuşma, düşünme, ezberleme, dinleme, kaydetme, vb. bu makalede, biz daha duralım böyle bi...
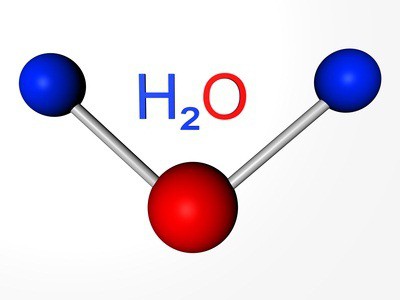
Öğelere karşılık basit maddeler: oksijen, kükürt, selenyum, tellür ve polonyum. İlk üç temsilci gösteren ametal özellikleri. Formülü oksijen —2. Аллотропное - aynı madde - ozon (O3). Her iki değişiklik için gazlar. Kükürt ve selenyum — katı olmayan metaller. Tellür — металлоидное madde, iletken, elektrik akımı, polonyum — metal.
Oksijen — en yaygın
Genel içeriği atomlar madde yerkabuğunun yaklaşık %47 oranında (ağırlık olarak). Oksijen bulunur hem serbest olarak, hem de oluşan çeşitli bileşikler. Basit bir madde, bir formül olduğu Hakkında2, atmosferik kompozisyon, muhasebe, 21 % oranı (hacimce). Moleküler oksijen çözünmüş su arasında yer alan toprak parçacıkları.
Biz zaten biliyoruz, ne var başka tür varlığı aynı kimyasal element şeklinde basit bir madde. Bu ozon — gaz oluşturan yükseklikte yaklaşık 30 km toprak yüzey tabakası, genellikle sözde ozon ekran tv bulunmaktadır. İlişkili oksijen girer, su molekülleri ile birlikte birçok kayalar ve mineraller, organik bileşikler.
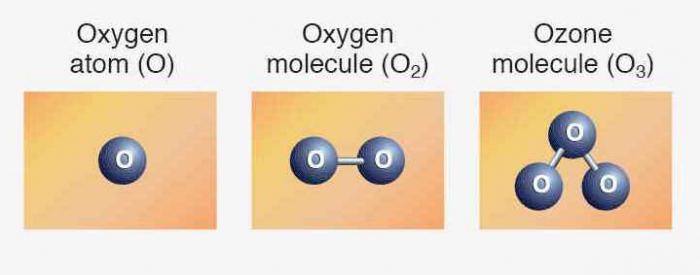
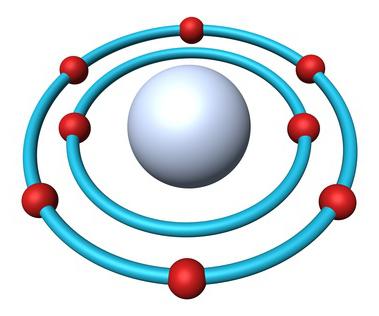
Atomun oksijen
Periyodik tablo Periyodik eksiksiz bilgi içerir oksijen:
- Sıra numarası, madde — 8.
- Şarj çekirdek — +8.
- Toplam elektron — 8.
- E-formülü oksijen — 1s22s22p4.
Doğada karşılaşılan üç kararlı izotopu olan aynı sıra numarası ve Periyodik tabloda, aynı kompozisyon proton ve elektron, ama farklı sayıda nötron vardır. Sayıları izotoplar aynı sembol — O. karşılaştırmak İçin işte bir düzeni, bir yansıtıcı kompozisyon üç oksijen izotoplarının:
Özellikleri oksijen — kimyasal madde
2p-alt atomun iki неспаренных elektron açıklar ortaya çıkması derece oksidasyon –2 ve +2. İki eşleşmiş elektron olamaz bağlantıyı kes için oksidasyon derecesi artmıştır sıcaklığı +4, kükürt ve diğer халькогенов. Nedeni — herhangi bir boş alt düzey. Bu nedenle, bağlantılar kimyasal element oksijen göstermiyor değerlik atlayabilirsiniz ve oksidasyon derecesi, eşit numarasına grubu kısa versiyonu periyodik sistem (6). Normal onun için oksidatif sayı –2.
Yalnızca bağlantıları ile flor oksijen sergiler нехарактерную onun için olumlu bir oksidasyon derecesi +2. Değeri EO iki güçlü ametal farklıdır: EO (O) = 3,5; EO (F) = 4. Daha электроотрицательный kimyasal element flor güçlü tutan kendi elektronlar ve çeker валентные parçacıklar dış enerji düzeyinde bir atom oksijen vardır. Bu nedenle, reaksiyon flor, oksijen, indirgeyici ajan, bir elektron verir.
Oksijen — basit madde
İngiliz araştırmacı Vb Priestley 1774 yılında sırasında deneyimleri saydı gaz ayrışma oksit cıva. İki yıl önce bu madde saf halde alınan K. Scheele. Sadece birkaç yıl sonra, fransız kimyacı A. Lavoisier yüklü, gaz parçası, hava, eğitimi ve özellikleri. Kimyasal formülü oksijen —2. Отразим kayıt bileşimi maddenin elektron katılan eğitim bir non-polar kovalent bağ " Hakkında::O. Yerini alacakher bağlama e bir çift bir özelliği: O=O. Böyle bir formül oksijen açıkça gösteriyor ki, atomlar molekül bağlı iki genel çiftleri elektron.

Uygulanabilir, basit hesaplamalar ve tanımlamak, neye eşittir bağıl moleküler kütlesi oksijen: Mr(O2) = Ar(O) x 2 = 16 x 2 = 32. Karşılaştırma için: Mr(hava) = 29. Kimyasal formülü oksijen farklı bir formül ozon bir oksijen atomu. Yani Mr(O3) = Ar(O) x 3 = 48. Ozon 1,5 kat daha ağır oksijen.
Fiziksel özellikler
Oksijen — bu gaz olmadan, renk, tat ve koku (normal sıcaklık ve basınç altında, eşit, hava direnci). Madde biraz havadan daha ağırdır; suda çözünür, ama küçük miktarlarda. Erime sıcaklığı, oksijen, negatif büyüklük ve ise –218,3 °C Noktası olan sıvı oksijen tekrar döner gazı, — bu onun kaynama noktası. İçin moleküller Hakkında2 değeri, bu fiziksel bir büyüklüğü ulaşır –182,96 °C. sıvı ve katı hal oksijen alır açık mavi rengi.
Alma oksijen lab
ısıtıldığında кислородосодержащих maddeler, örneğin potasyum permanganat, salgılanan renksiz bir gaz toplamak için bir şişe veya tüp. Eğer yapmak için saf oksijen yanan bir meşale, o zaman yanıyor, daha parlak, daha havada. Diğer iki laboratuvar yöntemi oksijen - ayrışma hidrojen peroksit ve хлората potasyum (бертолетовой tuz). Şeması göz önünde bulundurun cihaz için geçerli olan termal ayrışma.
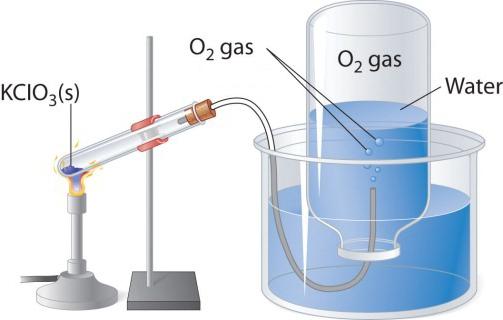
Bir test tüpü İçinde veya yuvarlak tabanlı bir şişe lazım hatta biraz бертолетовой tuz, kapatmak için tıpa ile газоотводной tüp. Onun diğer ucunu sevk edilmelidir (su altında) опрокинутую ters şişe. Boynu olmalıdır atlanmış geniş bir bardak veya кристаллизатор su ile dolu. Isıtıldığında test tüpleri ile бертолетовой tuz salgılanan oksijen. Ve газоотводной tüp geldiğinde, bir sürahi yerinden ondan su. Ne zaman ampul dolacak gaz, yakın, su altında tüp ulaştırır. Elde edilen bu laboratuvar deneyimleri oksijen incelemek için kullanabileceğiniz kimyasal özellikleri, basit bir madde.
Geciktirici
Bir laboratuvarda yapılır yakıcı madde oksijen, bilmek ve uymak yangın kuralları. Hidrojen anında yakar, havada ve ortalama oksijen oranı 2:1, o havayla. Yanan maddelerin saf oksijen çok daha yoğun, daha havada. Nedeniyle bu olgu bir kompozisyon olacak. Oksijen atmosferde ise biraz daha fazla 1/5 parçaları (21%). Yanma — bu reaksiyon maddelerin oksijen ile, hangi bir sonucu olarak oluşmuş, farklı ürünler, çoğunlukla metal oksitler ve ametal. Пожароопасны karışımı Hakkında2 gibi yanıcı maddeler, ayrıca, ortaya çıkan bağlantı toksik olabilir.
Yanan normal bir mum (veya maç) oluşumu eşlik eder, karbon dioksit. Bir sonraki deneyim geçirebilirsiniz evde. Eğer yakmak madde, bir cam kavanoz veya büyük bir bardak, bir yanma durur, bir kez tüketilen tüm oksijen. Azot desteklemiyor solunum ve yanma. Karbon dioksit — ürün, oksidasyon — artık ile reaksiyona girer oksijen. Berrak kireç suyu sağlar varlığını tespit karbon dioksit sonra yanan mumlar. Eğer atlamak yanma ürünleri ile kalsiyum hidroksit, çözelti bulanık olur. Kimyasal bir reaksiyon gerçekleşir arasında kireçli su ve karbondioksit çıkıyor çözünmeyen kalsiyum karbonat.

Alma oksijen endüstriyel ölçekte
Ucuz bir süreç sonucunda elde boş hava molekülleri Hakkında2 ile bağlı değildir yürütülmesi kimyasal reaksiyonlar. Sanayi, diyelim ki, çelik fabrikaları, hava daha düşük sıcaklıkta ve yüksek basınç сжижают. Bu önemli bileşenleri, atmosfer, azot ve oksijen, kaynamaya farklı sıcaklıklarda. Paylaşmak hava karışımı kademeli ısıtma kadar normal bir sıcaklık. İlk öne azot molekülleri, daha sonra oksijen. Yol ayrımı dayalı farklı fiziksel özellikleri basit bir madde. Formül basit maddeler oksijen ile aynıdır olmuştur. soğutma ve sıvılaştırma hava ve hava —2.
Sonuç olarak, bazı reaksiyonlar elektroliz de salgılanan oksijen toplanır üzerine uygun elektrot. Gaz ihtiyacı, endüstriyel, yapı, işletmelerin yüksek hacimli. Oksijen ihtiyacı sürekli artıyor, özellikle ihtiyacı kimya sanayi. Depolar elde edilen gaz üretim ve tıbbi amaçlar çelik silindir, sağlanan işaretleme. Kapasiteli oksijen ile boyanmış mavi veya mavi renk, ayırt etmek için diğer sıvılaştırılmış gazlar — azot, metan, amonyak.

Kimyasal hesaplamalar, formül ve denklemler içeren reaksiyonlar moleküller Hakkında2
Sayısal değeri molar kütlesi oksijen aynı olan başka bir büyüklük — bağıl moleküler kütlesi. Sadece ilk durumda, mevcut bir ölçü birimi. Kısaca formülü bir madde, oksijen ve molar kütlesi olmalıdır kaydedildi: M(O2) = 32 g/mol. Normal şartlarda duaherhangi bir karşılık gaz hacmi 22,4 l Yani, 1 mol Hakkında2 — bu 22,4 l madde 2 mol Hakkında2 — 44,8 l Ve denklem arasındaki reaksiyon, oksijen ve hidrojen görebilirsiniz etkileşim 2 dua hidrojen ve 1 mol oksijen:
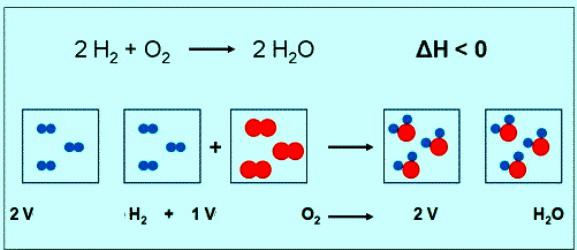
Eğer bir tepki katılır, 1 mol hidrojen, oksijen hacmi 0,5 mol • 22,4 litre/mol = 11,2 l
Rol molekülleri Hakkında2 doğa ve insan hayatı
Oksijen tüketilen canlılar Yeryüzünde ve yer döngüsünde maddeler üzerinde 3 milyar yıl. Önemli olan da bu madde solunum ve metabolizma ile gerçekleşir moleküllerin ayrışma besin sentez için gerekli organizmaların enerji. Oksijen sürekli tüketilen Yeryüzünde, ama onun stok doldurulan sayesinde фотосинтезу. Rus bilim adamı K. Тимирязев inanıyordu sayesinde bu süreci hala hayat var gezegende.

Büyük bir rol oksijen, doğada ve tarım:
- Tarafından emilir sırasında solunum canlılar;
- Dahil reaksiyonları fotosentez bitkilerde;
- Içerdiği organik moleküller;
- Süreci çürüyen, fermantasyon, ржавления yaşanıyor katılımı ile oksijen, konuşmacı olarak oksidan;
- Elde etmek için kullanılan değerli ürünlerin organik sentezi.
Sıvılaştırılmış oksijen silindir için kullanılan kesme ve kaynak metaller yüksek sıcaklıklarda. Bu süreci geçirirler mühendislik fabrikalar, ulaştırma ve inşaat şirketleri. Çalışmaları için su altında, toprak altında, yüksek irtifada, havasız alanda insanlar çok ihtiyacı moleküller Hakkında2. Oksijen yastığı tıpta uygulanan zenginleştirme bileşimi hava, solunan hasta insanlar. Gaz tıbbi amaçlar için farklı teknik hemen hemen yokluğu, yabancı madde, koku.

Oksijen — mükemmel bir oksitleyici ajan
Bilinen bir bileşiğin oksijen ile kimyasal elementlerin Periyodik tablonun dışında, ilk temsilcileri, ailesi, noble gazlar. Birçok maddenin doğrudan etkili reaksiyon atomları ile İlgili, hariç, halojenler, altın ve platin. Çok önemli olayları içeren, oksijen eşliğinde yayan ışık ve ısı. Bu süreçler yaygın olarak kullanılan ev, sanayi. Metalurji etkileşim cevher oksijen ile denir kızartma. Önceden ezilmiş cevheri ile karıştırılır, hava, zenginleştirilmiş oksijen. Yüksek sıcaklıklarda gerçekleşir kurtarma metallerin sülfür kadar basit bir madde. Öyle olsun demir ve bazı demir dışı metaller. Varlığı saf oksijen oranını artırır teknolojik süreçleri farklı sektörlerde kimya, mühendislik ve metalurji.
Görünümünü ucuz yolla havadaki oksijen ayırma yöntemi bileşenler düşük sıcaklıklarda uyarılmış gelişme birçok noktaya endüstriyel üretim. Kimyagerler inanıyorum molekül Hakkında2 Ve atomlar Hakkında mükemmel окислительными ajanlar. Bu doğal malzemeler, onlar sürekli yenilenen doğada, çevreyi kirletmez. Buna ek olarak, kimyasal reaksiyon içeren oksijen en sık bitirilir sentezi için başka bir doğal ve güvenli bir ürün — su. Büyük rolü Hakkında2 takas toksik endüstriyel atık su arıtma tesisi kirletici. Buna oksijen dezenfeksiyonu için kullanılır аллотропная modifikasyon — ozon. Bu, basit bir madde, yüksek oksidatif aktiviteye. Bir озонировании su ayrıştırmak kirletici maddeler. Ozon da zararlı etkisi болезнетворную mikroflorası.
Article in other languages:
KK: https://tostpost.com/kk/b-l-m/20346-formulasy-otteg-mendeleevt-periodty-kestes---otteg.html
PL: https://tostpost.com/pl/edukacja/20321-formu-a-tlenu-uk-ad-okresowy-mendelejewa---tlen.html
UK: https://tostpost.com/uk/osv-ta/20338-formula-kisnyu-per-odichna-tablicya-mendel-va---kisen.html

Alin Trodden - makalenin yazarı, editör
"Merhaba, ben Alin Trodden. Metin, kitap okumak, yazmak ve Gösterimler için bak. Ve sana söylüyorum.kötü değilim. İlginç projelere katılmaktan her zaman mutluluk duyarım."
İlgili Haberler
Harun ar-Raşid: hedefler, başarılar, rakipler. Yönetim kurulu, Harun ar-Rashid
İkinci yarı 8 yüzyılda ознаменовалась merkezi otoritenin zayıflaması ve uzak bölgelerde Hilafet var yeni bir ivme geliştirmek. Bir arka plan üzerinde genel değişiklikler özellikle göze çarpıyordu Bağdat. Oldukça hızlı bir şekilde ...
Yapan amacıyla kendini yakan budist rahip. Kendi 1963
Tarihin bilinen şaşırtıcı durumlarda, insanlar bir nedenle veya başka için çözüldü eylemleri, intihar, поджигая kendini ve yanan diri diri. Bu form intihar denir самосожжением, ve çoğu durumda, bir adam, ancak, onun bu devlet için...
Yüksek Ortaçağ sanat ve kültür:
Yüksek Ortaçağ - bir belirleyici dönemler, insanlık tarihinin. O uzak ve karanlık zamanlarda oluşan çağdaş uygarlık. Kayboldu eski temeller ve ortaya yeni. Önemli ölçüde arttı nüfus. Meydana gelen kültür bir darbe. Kabileler yasak...
Мздоимство - bu bizim geçmişte veya şu anda?
Bugün, biz hakkında konuşmak eski bir kelime, bir uzun sürdü, günlük ev eşyaları sıradan bir adam. Zaman ileri gider ve birçok kelime haline архаизмами olmayan kök yeni bir ortamda. En komiği de şudur, o bir fenomen, обозначаемое ...
Sumy devlet üniversitesi: adres, fakülteleri, özel
Sumy devlet üniversitesi – bu bir yüksek öğrenim Ukrayna. ÜNİVERSİTE yeterince yüksek bir konum, uluslararası sıralamada. Yer üniversitesi Sumy (şehir ana alanında). Eğitim devam etmekte, birçok insani ve teknik uzmanlık. Re...
Adam: taksonomi ve karakteristik özellikleri, yapısı, vücudun
Özel bir yere sisteminde organik bir dünya kişi alır. Taksonomi bu bir biyolojik türün kendi özellikleri vardır. İlgili onlar ile биосоциальной temeli yazmışlardır.Adam: taksonomibir yandan, bir kişi, bir nesne, bir canlı, doğanın...




















Yorumlar (0)
Bu makalede Yorum yok, ilk olmak!