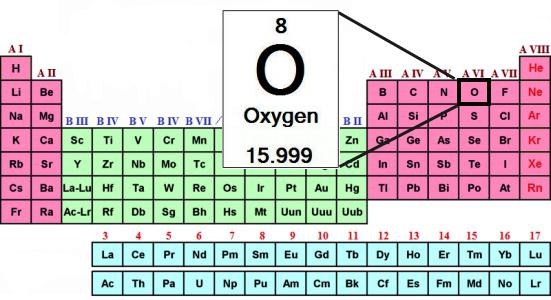
Формула кіслароду. Перыядычная табліца Мендзялеева - кісларод
Хімічны элемент кісларод знаходзіцца ў другім перыядзе VI-ой галоўнай групы састарэлага кароткага варыянту перыядычнай табліцы. Па новым стандартам нумарацыі — гэта 16-я група. Адпаведнае рашэнне прынята ІЮПАК ў 1988 годзе. Формула кіслароду як простага рэчывы — Пра2. Разгледзім яго асноўныя ўласцівасці, ролю ў прыродзе і гаспадарцы. Пачнем з характарыстыкі ўсёй групы перыядычнай сістэмы, якую ўзначальвае кісларод. Элемент адрозніваецца ад роднасных яму халькогенов, а вада адрозніваецца ад вадародных злучэнняў серы, селену і тэлура. Тлумачэнне ўсім адметным рысах можна знайсці, толькі даведаўшыся аб будове і ўласцівасцях атама.
Халькогены — роднасныя кіслароду элементы
Падобныя па ўласцівасцях атамы ўтвараюць адну групу ў перыядычнай сістэме. Кісларод ўзначальвае сямейства халькогенов, але адрозніваецца ад іх па шэрагу уласцівасцяў.
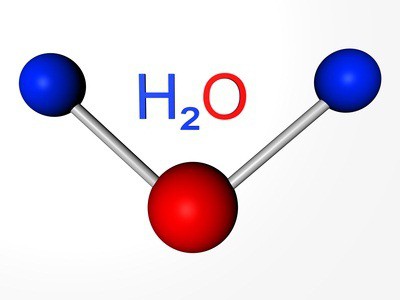
Атамная маса кіслароду — родапачынальніка групы — складае 16 а. е. м. Халькогены пры адукацыі злучэнняў з вадародам і металамі праяўляюць сваю звычайную ступень акіслення: –2. Напрыклад, у складзе вады (Н2О) акісляльнае лік кіслароду роўна –2.
Склад тыповых вадародных злучэнняў халькогенов адказвае агульнай формуле: Н2R. Пры растварэнні гэтых рэчываў ўтворацца кіслаты. Толькі вадароднае злучэнне кіслароду — вада — валодае асаблівымі ўласцівасцямі. Паводле высноваў навукоўцаў, гэта незвычайнае рэчыва з'яўляецца і вельмі слабой кіслатой, і вельмі слабым падставай.
Сера, селен і теллур маюць тыповыя станоўчыя ступені акіслення (+4, +6) у злучэннях з кіслародам і іншымі неметаллов, якія валодаюць высокай электроотрицательностью (ЭО). Склад аксідаў халькогенов адлюстроўваюць агульныя формулы: RO2, RO3. Адпаведныя ім кіслаты маюць склад: H2RO3 H2RO4.
Больш:
Нервовы імпульс, яго пераўтварэнне і механізм перадачы
Нервовая сістэма чалавека выступае своеасаблівым каардынатарам у нашым арганізме. Яна перадае каманды ад мозгу мускулатуры, органаў, тканін і апрацоўвае сігналы, якія ідуць ад іх. У якасці своеасаблівага носьбіта дадзеных выкарыстоўваецца нервовы імп...
Куды паступаць пасля 11 класа? Якую выбраць прафесію?
Пры выбары сваёй будучай прафесіі не варта абапірацца на чые-то рэкамендацыі і парады, тым больш не трэба падпарадкоўвацца сваім бацькам, якія даволі часта вырашаюць без вас самастойна, куды паступіць пасля 11 класа. Варта задумацца, наколькі паспяхо...
Крывяносная сістэма жывёл, як вынік эвалюцыйнага развіцця свету
Крывяносная сістэма жывёл прайшла доўгі шлях фарміравання ў ходзе эвалюцыйнага развіцця свету. Яна ўтварылася на месцы рудыментарных частак першаснай паражніны цела, якая ў вышэйшых жывёл была выцесненая целломом, або другаснай паражніной цела. У пра...
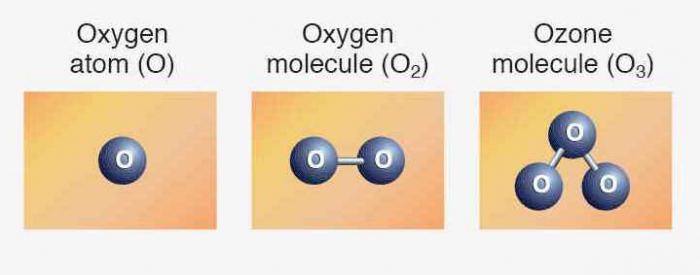
Элементаў адпавядаюць простыя рэчывы: кісларод, сера, селен, тэлура і палоній. Першыя тры прадстаўніка праяўляюць неметалічныя ўласцівасці. Формула кіслароду — Пра2. Аллотропное перайначванне таго ж элемента - азон (Пра3). Абедзве мадыфікацыі з'яўляюцца газамі. Сера і селен — цвёрдыя неметалы. Теллур — металлоидное рэчыва, правадыр электрычнага току, палоній — метал.
Кісларод — самы распаўсюджаны элемент
Агульнае ўтрыманне атамаў элемента ў зямной кары складае прыкладна 47 % (па вазе). Кісларод сустракаецца як у вольным выглядзе, так і ў складзе шматлікіх злучэнняў. Простае рэчыва, формула якога Аб2, знаходзіцца ў складзе атмасферы, складаючы 21 % паветра (па аб'ёме). Малекулярны кісларод раствораны ў вадзе, знаходзіцца паміж часцінкамі глебы.
Мы ўжо ведаем, што ёсць іншая разнавіднасць існавання таго ж самага хімічнага элемента ў форме простага рэчывы. Гэта азон — газ, які ўтварае на вышыні каля 30 км ад паверхні зямлі пласт, часта званы азонавы экран. Звязаны кісларод ўваходзіць у малекулы вады, у склад многіх горных парод і мінералаў, арганічных злучэнняў.
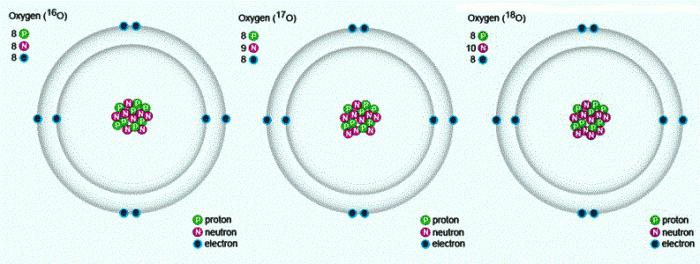
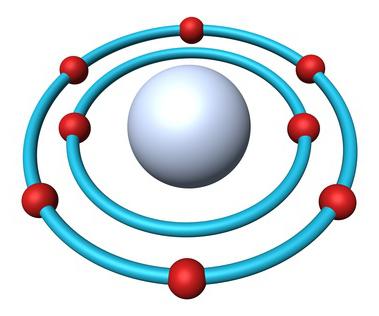
Будова атама кіслароду
Перыядычная табліца Мендзялеева змяшчае поўную інфармацыю аб кіслародзе:
- Парадкавы нумар элемента — 8.
- Зарад ядра — +8.
- Агульнае лік электронаў — 8.
- Электронная формула кіслароду — 1s22s22p4.
У прыродзе сустракаюцца тры стабільных ізатопа, якія маюць аднолькавы парадкавы нумар у табліцы Мендзялеева, ідэнтычны склад пратонаў і электронаў, але розны лік нейтронаў. Пазначаюцца ізатопы адным і тым жа сімвалам — А. Для параўнання прывядзем схему, якая адлюстроўвае склад трох ізатопаў кіслароду:
Ўласцівасці кіслароду — хімічнага элемента
На 2р-подуровне атама маюцца два неспаренных электрона, што тлумачыць з'яўленне ступеняў акіслення –2 +2. Два спараных электрона не могуць разъединиться, каб ступень акіслення ўзрасла да +4, як у серы і іншых халькогенов. Прычына — адсутнасць вольнага подуровней. Таму ў злучэннях хімічны элемент кісларод не праяўляе валентнасць і ступень акіслення, роўныя нумары групы ў кароткім варыянце перыядычнай сістэмы (6). Звычайнае для яго акісляльнае лік роўна –2.
Толькі ў злучэннях з фторам кісларод праяўляе нехарактэрную для яго станоўчую ступень акіслення +2. Значэнне ЭО двух моцных неметаллов адрозніваецца: ЭО (АБ) = 3,5; ЭО (F) = 4. Як больш электроотрицательный хімічны элемент, фтор мацней ўтрымлівае свае электроны і прыцягвае валентныя часціцы на знешнім энергетычным узроўні атама кіслароду. Таму ў рэакцыі з фторам кісларод з'яўляецца адраджэнцам, аддае электроны.
Кісларод — простае рэчыва
Англійская даследчык Д. Прыстлі ў 1774 годзе ў ходзе досведаў вылучыў газ пры раскладанні аксіду ртуці. Двума гадамі раней гэтая ж рэчыва ў чыстым выглядзе атрымаў К. Шэель. Толькі праз некалькі гадоў французскі хімік А. Лавуазье вызначыў, што за газ ўваходзіць у склад паветра, вывучыў ўласцівасці. Хімічная формула кіслароду — Пра2. Адлюстраваў у запісу складу рэчывы электроны, якія ўдзельнічаюць у адукацыі неполярной кавалентнай сувязі — Пра::А. Заменімкожную якая злучае электронную пару адной рысай: О=О. Такая формула кіслароду наглядна паказвае, што атамы ў малекуле звязаны паміж двума агульнымі парамі электронаў.

Выканаем нескладаныя разлікі і вызначым, чаму роўная адносная малекулярная маса кіслароду: Mr(O2) = Ar(O) х 2 = 16 х 2 = 32. Для параўнання: Mr(возд.) = 29. Хімічная формула кіслароду адрозніваецца ад формулы азону на адзін атам кіслароду. Значыць, Mr(O3) = Ar(O) х 3 = 48. Азон ў 1,5 разы цяжэй кіслароду.
Фізічныя ўласцівасці
Кісларод — гэта газ без колеру, густу і паху (пры звычайнай тэмпературы і ціску, роўным атмасфернаму). Рэчыва трохі цяжэй паветра; раствараецца ў вадзе, але ў невялікіх колькасцях. Тэмпература плаўлення кіслароду з'яўляецца адмоўнай велічынёй і складае –218,3 °C. Кропка, у якой вадкі кісларод зноў ператвараецца ў газападобны, — гэта яго тэмпература кіпення. Для малекул Аб2 значэнне гэтай фізічнай велічыні дасягае –182,96 °C. У вадкім і цвёрдым стане кісларод набывае светла-сінюю афарбоўку.
Атрыманне кіслароду ў лабараторыі
Пры награванні кислородосодержащих рэчываў, напрыклад перманганата калія, вылучаецца бескаляровы газ, які можна сабраць у колбу або прабірку. Калі ўнесці ў чысты кісларод запаленую лучыну, то яна гарыць больш ярка, чым у паветры. Два іншых лабараторных спосабу атрымання кіслароду - раскладанне пераксіду вадароду і хлората калію (бертолетовой солі). Разгледзім схему прыбора, які ўжываецца для тэрмічнага раскладання.
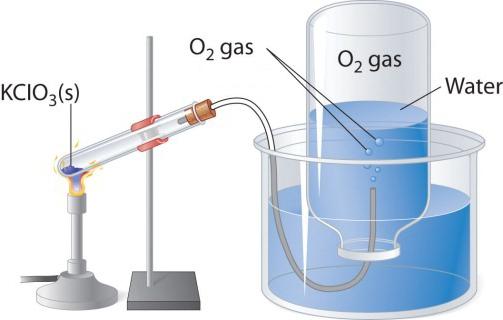
У прабірку або круглодонную колбу трэба насыпаць трохі бертолетовой солі, зачыніць коркам з газоотводной трубачкай. Яе супрацьлеглы канец варта накіраваць (пад вадой) у перакуленую дагары дном колбу. Рыльца павінна быць апушчана ў шырокі шклянку або кристаллизатор, напоўнены вадой. Пры награванні прабіркі з бертолетовой соллю вылучаецца кісларод. Па газоотводной трубцы ён паступае ў колбу, выцясняючы з яе ваду. Калі колба напоўніцца газам, яе закрываюць пад вадой коркам і перагортваюць. Атрыманы ў гэтым лабараторным вопыце кісларод можна выкарыстоўваць для вывучэння хімічных уласцівасцяў простага рэчывы.
Гарэнне
Калі ў лабараторыі праводзіцца спальванне рэчываў у кіслародзе, то трэба ведаць і выконваць супрацьпажарныя правілы. Вадарод імгненна згарае ў паветры, а змяшаны з кіслародам у суадносінах 2:1, ён выбуханебяспечны. Гарэнне рэчываў у чыстым кіслародзе адбываецца нашмат больш інтэнсіўна, чым у паветры. Тлумачыцца гэта з'ява складам паветра. Кісларод у атмасферы складае крыху больш за 1/5 часткі (21%). Гарэнне — гэта рэакцыя рэчываў з кіслародам, у выніку якой утвараюцца розныя прадукты, у асноўным аксіды металаў і неметаллов. Пажаранебяспечныя сумесі Аб2 з гаручымі рэчывамі, акрамя таго, атрыманыя злучэння могуць быць таксічнымі.
Гарэнне звычайнай свечкі (ці запалкі) суправаджаецца адукацыяй дыяксіду вугляроду. Наступны вопыт можна правесці ў хатніх умовах. Калі спальваць рэчыва пад шкляной слоікам ці вялікім шклянкай, то гарэнне спыніцца, як толькі выдаткуецца ўвесь кісларод. Азот не падтрымлівае дыханне і гарэнне. Вуглякіслы газ — прадукт акіслення — больш не ўступае ў рэакцыю з кіслародам. Празрыстая вапнавая вада дазваляе выявіць прысутнасць дыяксіду вугляроду пасля гарэння свечкі. Калі прапускаць прадукты гарэння праз гідраксід кальцыя, то раствор мутнее. Адбываецца хімічная рэакцыя паміж вапнавай вадой і вуглякіслым газам, атрымліваецца нерастваральны карбанат кальцыя.

Атрыманне кіслароду ў прамысловых маштабах
Самы танны працэс, у выніку якога атрымліваюцца свабодныя ад паветра малекулы Аб2, не звязаны з правядзеннем хімічных рэакцый. У прамысловасці, скажам, на металургічных камбінатах, паветра пры нізкай тэмпературы і высокім ціску сжижают. Такія найважнейшыя кампаненты атмасферы, як азот і кісларод, кіпяць пры розных тэмпературах. Падзяляюць паветраную сумесь пры паступовым награванні да звычайнай тэмпературы. Спачатку вылучаюцца малекулы азоту, затым кіслароду. Спосаб падзелу заснаваны на розных фізічных уласцівасцях простых рэчываў. Формула простага рэчывы кіслароду такая ж, як была да астуджэння і звадкаванні паветра, — Пра2.
У выніку некаторых рэакцый электролізу таксама вылучаецца кісларод, яго збіраюць над адпаведным электродам. Газ патрэбен прамысловым, будаўнічым прадпрыемствам у вялікіх аб'ёмах. Патрэбы ў кіслародзе пастаянна растуць, асабліва мае патрэбу ў ім хімічная прамысловасць. Захоўваюць атрыманы газ для вытворчых і медыцынскіх мэтаў у сталёвых балонах, забяспечаных маркіроўкай. Ёмістасці з кіслародам афарбоўваюць у сіні або блакітны колер, каб адрозніваць ад іншых звадкаваных газаў — азоту, метану, аміяку.

Хімічныя разлікі па формуле і раўнаннях рэакцый з удзелам малекул Аб2
Лікавае значэнне малярнай масы кіслароду супадае з другога велічынёй — адноснай малекулярнай масай. Толькі ў першым выпадку прысутнічаюць адзінкі вымярэння. Коратка формула рэчывы кіслароду і яго малярнай масы павінна быць запісана так: М(Аб2) = 32 г/моль. Пры нармальных умовах малюлюбога газу адпавядае аб'ём 22,4 л. Значыць, 1 моль Аб2 — гэта 22,4 л рэчывы, 2 моль Аб2 — 44,8 л. Па раўнанні рэакцыі паміж кіслародам і вадародам можна заўважыць, што ўзаемадзейнічаюць 2 молячы вадароду і 1 моль кіслароду:
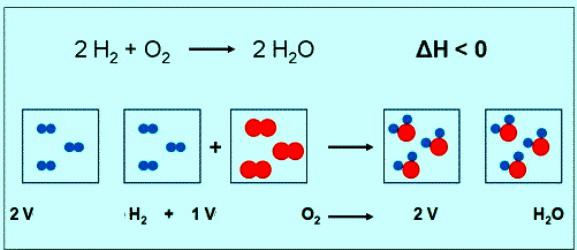
Калі ўдзельнічае ў рэакцыі 1 моль вадароду, то аб'ём кіслароду складзе 0,5 моль • 22,4 л/моль = 11,2 л.
Роля малекул Аб2 у прыродзе і жыцці чалавека
Кісларод спажываецца жывымі арганізмамі на Зямлі і ўдзельнічае ў кругавароце рэчываў больш за 3 млрд гадоў. Гэта галоўнае рэчыва для дыхання і метабалізму, з яго дапамогай адбываецца раскладанне малекул пажыўных рэчываў, сінтэзуецца неабходная для арганізмаў энергія. Кісларод пастаянна расходуецца на Зямлі, але яго запасы папаўняюцца дзякуючы фотосинтезу. Рускі навуковец К. Тимирязев лічыў, што дзякуючы менавіта гэтаму працэсу да гэтага часу існуе жыццё на нашай планеце.

Вялікая роля кіслароду ў прыродзе і гаспадарцы:
- паглынаецца ў працэсе дыхання жывымі арганізмамі;
- ўдзельнічае ў рэакцыях фотасінтэзу ў раслінах;
- ўваходзіць у склад арганічных малекул;
- працэсы гніення, закісання, іржаўлення працякаюць пры ўдзеле кіслароду, які выступае ў якасці акісляльніка;
- выкарыстоўваецца для атрымання каштоўных прадуктаў арганічнага сінтэзу.
Звадкаваны кісларод у балонах выкарыстоўваюць для рэзкі і зваркі металаў пры высокіх тэмпературах. Гэтыя працэсы праводзяць на машынабудаўнічых заводах, на транспартных і будаўнічых прадпрыемствах. Для правядзення работ пад вадой, пад зямлёй, на вялікай вышыні ў беспаветранай прасторы людзі таксама маюць патрэбу ў малекулах Аб2. Кіслародныя падушкі прымяняюцца ў медыцыне для ўзбагачэння складу паветра, удыхальнага хворымі людзьмі. Газ для медыцынскіх мэтаў адрозніваецца ад тэхнічнага практычна поўнай адсутнасцю старонніх прымешак, паху.

Кісларод — ідэальны акісляльнік
Вядомыя злучэння кіслароду з усімі хімічнымі элементамі табліцы Мендзялеева, акрамя першых прадстаўнікоў сямейства высакародных газаў. Многія рэчывы непасрэдна ўступаюць у рэакцыі з атамамі Аб, выключаючы галагены, золата і плаціну. Вялікае значэнне маюць з'явы з удзелам кіслароду, якія суправаджаюцца вылучэннем святла і цяпла. Такія працэсы шырока выкарыстоўваюцца ў побыце, прамысловасці. У металургіі ўзаемадзеянне руд з кіслародам называюць абпалам. Папярэдне здробненую руду змешваюць з паветрам, узбагачаным кіслародам. Пры высокіх тэмпературах адбываецца аднаўленне металаў з сульфід да простых рэчываў. Так атрымліваюць жалеза і некаторыя каляровыя металы. Прысутнасць чыстага кіслароду павышае хуткасць тэхналагічных працэсаў у розных галінах хіміі, тэхніцы і металургіі.
З'яўленне таннага спосабу атрымання кіслароду з паветра метадам падзелу на кампаненты пры нізкай тэмпературы стымулявала развіццё многіх напрамкаў прамысловага вытворчасці. Хімікі лічаць малекулы Аб2 і атамы Аб ідэальнымі акісляльных агентамі. Гэта натуральныя матэрыялы, яны пастаянна аднаўляюцца ў прыродзе, не забруджваюць навакольнае асяроддзе. Акрамя таго, хімічныя рэакцыі з удзелам кіслароду часцей за ўсё завяршаюцца сінтэзам яшчэ аднаго натуральнага і бяспечнага прадукту — вады. Вялікая роля Аб2 ў абясшкоджванні таксічных вытворчых адходаў, ачыстцы вады ад забруджванняў. Акрамя кіслароду, для абеззаражання выкарыстоўваецца яго аллотропная мадыфікацыя — азон. Гэта простае рэчыва валодае высокай акісляльнай актыўнасцю. Пры озонировании вады раскладаюцца забруджвальныя рэчывы. Азон таксама пагібельна дзейнічае на хваробатворных мікрафлору.
Article in other languages:
KK: https://tostpost.com/kk/b-l-m/20346-formulasy-otteg-mendeleevt-periodty-kestes---otteg.html
PL: https://tostpost.com/pl/edukacja/20321-formu-a-tlenu-uk-ad-okresowy-mendelejewa---tlen.html
TR: https://tostpost.com/tr/e-itim/20355-form-l-oksijen-periyodik-tablo-periyodik---oksijen.html
UK: https://tostpost.com/uk/osv-ta/20338-formula-kisnyu-per-odichna-tablicya-mendel-va---kisen.html

Alin Trodden - аўтар артыкула, рэдактар
"Прывітанне, Я Алін Тродден. Я пішу тэксты, чытаю кнігі і шукаю ўражанні. І я нядрэнна ўмею распавядаць вам пра гэта. Я заўсёды рады ўдзельнічаць у цікавых праектах."
Навіны
Што такое 3g: разуменне сеткі ў маштабах чалавецтва
Ужо даўно ўсе забыліся аб 2G, цяпер стандартам доступу стала сетку 3g. Што гэта? Невялікае прылада? Збольшага так, але сутнасць сістэмы доступу да мабільнай сувязі і Інтэрнэт значна складаней. Прылада Усяго пяць гадоў таму прылада...
Харун ар-Рашыд: мэты, дасягненні, праціўнікі. Праўленне Харун ар-Рашыда
Другая палова 8-га стагоддзя нашай эры адзначылася паслабленнем цэнтральнай улады, і аддаленыя раёны Халіфата атрымалі новы штуршок да развіцця. На фоне усеагульных змяненняў асабліва вылучаўся Багдад. Даволі хутка ён ператварыўся...
Высокае Сярэднявеччы: мастацтва і культура
Высокае Сярэднявечча - адзін з вызначальных перыядаў у гісторыі чалавецтва. У тыя далёкія і цёмныя часы фармавалася сучасная цывілізацыя. Знікалі старажытныя асновы і з'яўляліся новыя. Значна павялічылася колькасць насельніцтва. А...
Хабарніцтва - гэта наша мінулае ці сапраўднае?
Сёння мы пагаворым аб састарэлым слове, якое даўно сышло з паўсядзённага ўжытку звычайнага чалавека. Час ідзе наперад і многія словы становяцца архаизмами, якія не прыжываюцца ў новай асяроддзі. Самае цікавае складаецца ў тым, што...
Сумскай дзяржаўны універсітэт: адрас, факультэты, спецыяльнасці
Сумскай дзяржаўны універсітэт – гэта адно з вышэйшых навучальных устаноў Украіны. ВНУ мае дастаткова высокія пазіцыі ў міжнародных рэйтынгах. Размешчаны універсітэт у г. Сумы (горад з'яўляецца галоўным у вобласці). Навучанне...
Чалавек: сістэматыка і характэрныя прыкметы ў будове арганізма
Асаблівае месца ў сістэме арганічнага свету займае чалавек. Сістэматыка гэтага біялагічнага віду мае свае асаблівасці. Звязаныя яны з биосоциальной асновай Чалавека разумнага.Чалавек: сістэматыкаЗ аднаго боку, чалавек з'яўляецца а...




















Заўвага (0)
Гэтая артыкул не мае каментароў, будзьце першым!