Formel Sauerstoff. Periodensystem der Mendelejew - Sauerstoff
Chemisches Element Sauerstoff befindet sich in der zweiten Periode VI-TEN der Gruppe veralteten kurze Variante des Periodensystems. Nach den neuen Standards der Nummerierung ä diese 16-Gruppe. Die relevante Entscheidung wird von der IUPAC im Jahr 1988. Formel Sauerstoff als einfache Substanz ä O2. Betrachten Sie seine wichtigsten Eigenschaften, Rolle in der Natur und Landwirtschaft. Beginnen wir mit den Eigenschaften der ganzen Gruppe des Periodensystems, die von Sauerstoff. Das Element unterscheidet sich von ihm bedingten халькогенов, und das Wasser unterscheidet sich vom Wasserstoff-verbindungen von Schwefel, Selen und Tellur. Eine Erklärung für alle Top-Adressen, nur nach dem lernen über die Struktur und Eigenschaften des atoms.
Халькогены ä bedingte Sauerstoff-Elemente
Die Ähnlichen Eigenschaften der Atome bilden eine Gruppe des Periodensystems. Sauerstoff leitet die Familie халькогенов, unterscheidet sich aber von Ihnen durch eine Reihe von Eigenschaften.
Atommasse Sauerstoff ä Vorfahr der Gruppe der ä beträgt 16. E. M. Халькогены bei der Bildung von verbindungen mit Wasserstoff und Metallen zeigen Ihren üblichen Grad der Oxidation: –2. Zum Beispiel, im Bestande von Wasser (H2O) Anzahl der oxidative Sauerstoff gleich –2.
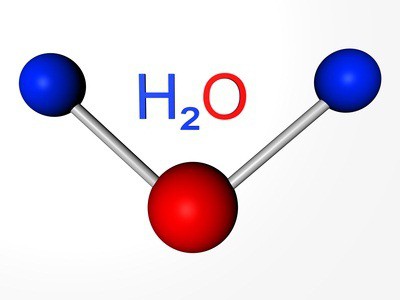
Typische Zusammensetzung von Wasserstoff-verbindungen халькогенов entspricht der Allgemeinen Formel: N2R. Beim auflösen dieser Substanzen werden Säuren. Nur Wasserstoff-Sauerstoff-Verbindung " Wasser " hat Besondere Eigenschaften. Nach den Erkenntnissen der Wissenschaftler, diese ungewöhnliche Substanz ist eine sehr schwache Säure, und sehr schwache Basis.
Schwefel, Selen und Tellur sind typische positive Oxidationsstufe (+4, +6), in verbindungen mit Sauerstoff und anderen nicht-Metallen, mit hoher электроотрицательностью (EO). Die Zusammensetzung der Oxide халькогенов spiegeln die Allgemeine Formel: RO2, RO3. Die entsprechenden Säure eine Zusammensetzung von: H2RO3 H2RO4.
Mehr:
Das Deutsche Flugzeug "Messerschmitt-262": die Geschichte der Entstehung, Merkmale, Foto
High-Speed-Strahltriebwerk-Kämpfer-Abfangjäger Messerschmitt ME-262 Schwalbe („Messerschmitt ME-262 Schwalbe») erschien auf dem Schlachtfeld nur im Jahr 1944. Man kann nicht genau sagen, für welchen Job diese Maschine bestimmt. Experiment...
Moderne Schule: Geschichte, Voraussetzungen, Probleme. Modelle der modernen Schulen
Historische Entstehung von Schulen förderte den Wunsch der Menschen die Welt zu erkennen und erweitern Ihre Kenntnisse. Deshalb versucht der Mensch zur Gemeinschaft mit den weisen und sehnte sich danach von Ihnen zu lernen wissen.die Geschichte der m...
"Haare zu Berge": Bedeutung, Herkunft фразеологизма
In der Russischen Sprache treffen eine ausreichende Anzahl von geheimnisvollen Floskeln, über deren Bedeutung schwer zu erraten. Die sprachliche Konstruktion „die Haare» gehört eindeutig zu den solchen. Zum Glück, der Ursprung dieses Ausd...
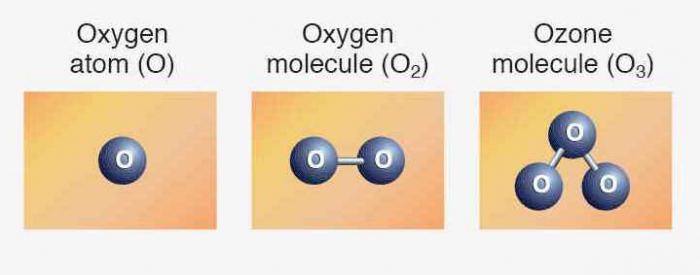
- Elemente entsprechen einfache Stoffe: Sauerstoff, Schwefel, Selen, Tellur und Polonium. Die ersten drei Vertreter zeigen Nichtmetallische Eigenschaften. Die Formel für Sauerstoff ä Über das2. Eine allotrope Modifikation von dem gleichen Element - Ozon (O3). Beide Varianten sind Gase. Schwefel und Selen ä Feste Nichtmetalle. Tellur ä металлоидное Substanz, Leiter des elektrischen Stroms, Polonium ä Metall.
Sauerstoff ä häufigste Element
Der gesamte Inhalt der Atome des Elements in der Erdhülle beträgt etwa 47 % (nach Gewicht). Sauerstoff kommt sowohl in freier Form, als auch im Bestande von zahlreichen verbindungen. Einfache Substanz, Über dessen Formel2, liegt in der Zusammensetzung der Atmosphäre, Bilanzierung von 21 % der Luft (nach Volumen). Molekularer Sauerstoff im Wasser aufgelöst wird, befindet sich zwischen den Teilchen des Bodens.
Wir wissen bereits, dass es eine andere Art der Existenz desselben chemischen Elements in Form eines einfachen Stoffes. Das Ozon ä Gas, bildet auf einer Höhe von etwa 30 km von der Oberfläche der Schicht der Erde, oft als озоновым TV. Verbundene Sauerstoff ist im Wasser-Molekül, Bestandteil vieler Gesteine und Mineralien, organische verbindungen.
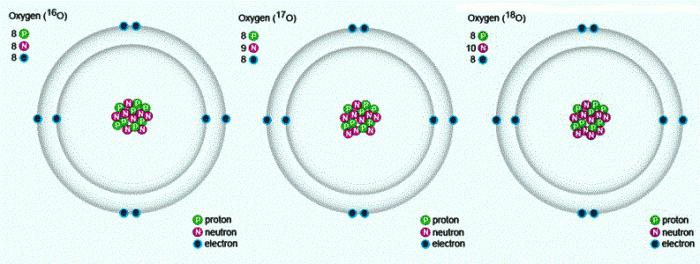
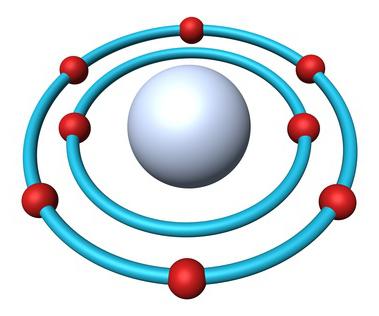
Struktur des atoms Sauerstoff
Mendelejews Periodensystem enthält die vollen Informationen über Sauerstoff:
- Die Ordnungszahl des Elements ä 8.
- Ladung des Kerns ä +8.
- Anzahl der Elektronen ä 8.
- E-Formel für Sauerstoff ä 1s22s22p4.
In der Natur gibt es drei stabile Isotope, die die gleiche Ordnungszahl im Periodensystem, ist identisch mit der Zusammensetzung von Protonen und Elektronen, aber eine unterschiedliche Anzahl Neutronen. Bezeichnet Isotope ein und dasselbe Symbol von ä O. Zum Vergleich geben wir einen überblick über die Zusammensetzung der drei Sauerstoff-Isotope:
Eigenschaften von Sauerstoff ä chemisches Element
Auf 2P-Atom-Unterebene gibt es zwei неспаренных Elektron, was erklärt die Entstehung von Oxidationsstufen –und 2 +2. Zwei gepaarten Elektronen nicht trennen können, um den Grad der Oxidation erhöht bis +4, wie bei Schwefel und anderen халькогенов. Ursache ä kein freier Unterebene. Also in verbindungen das Chemische Element Sauerstoff zeigt sich die Wertigkeit und der Grad der Oxidation gleich der Nummer der Gruppe in Kurzversion des Periodensystems (6). Normal für ihn oxidative Wert –2.
Nur in verbindungen mit Fluor Sauerstoff zeigt ungewöhnlich für ihn positiven oxidationszustand +2. Der Wert EO zwei starken Nichtmetalle unterscheidet: EO (O) = 3,5; EO (F) = 4. Wie mehr электроотрицательный chemisches Element, Fluorid stärker hält Ihre Elektronen und zieht die Valenzelektronen sind die Partikel auf der äußeren Energiestufe Sauerstoffatom. Also in der Reaktion mit Sauerstoff Fluor ist ein Reduktionsmittel gibt Elektronen.
Sauerstoff ä einfache Substanz
Der Englische Forscher D. Priestley im Jahre 1774 im Zuge der Experimente herausgegriffen Gas bei der Zersetzung von quecksilberoxyd. Zwei Jahre zuvor ist die gleiche Substanz in reiner Form erhielt K. Scheele. Nur wenige Jahre später der französische Chemiker A. Lavoisier stellte fest, dass für das Gas tritt in der Zusammensetzung der Luft, Eigenschaften untersucht. Chemische Formel Sauerstoff ä Über das2. Flip Einträge in der Zusammensetzung der Stoffe Elektronen, die sich an der Bildung der unpolaren kovalenzbindung — A::A: Ersetzenjeder verbindet ein paar mit einer E Merkmal: O=O. Diese Formel von Sauerstoff zeigt deutlich, dass die Atome im Molekül verbunden sind, zwischen den beiden gemeinsamen Paare von Elektronen.

Führen einfache Berechnungen und definieren, was ist die relative molare Masse von Sauerstoff: Mr(O2) = Ar(O) x 2 = 16 x 2 = 32. Zum Vergleich: Mr(SRS.) = 29. Chemische Formel Sauerstoff unterscheidet sich von der Formel von Ozon ein Sauerstoffatom. Also, Mr(O3) = Ar(O) x 3 = 48. Ozon ist 1,5 mal schwerer als Sauerstoff.
Physikalische Eigenschaften
Sauerstoff — ein Gas ohne Farbe, Geschmack und Geruch (bei normalen Temperaturen und einem Druck gleich dem Atmosphärendruck). Der Stoff ist ein bisschen schwerer als Luft; löst sich in Wasser, aber in kleinen Mengen. Die Schmelztemperatur von Sauerstoff ist ein negativer Wert und ist ü218,3 °C. der Punkt, an dem wieder flüssiger Sauerstoff verwandelt sich in das gasförmige, — das ist sein Siedepunkt. Für Moleküle Über2 der Wert dieser physikalischen Größe erreicht –182,96 °C. Im flüssigen und festen Zustand Sauerstoff erwirbt die helle-Blaue Farbe.
Getting Sauerstoff im Labor
Beim erhitzen enthaltende Stoffe, Z. B. Kaliumpermanganat, zeichnet sich farbloses Gas, die Sie sammeln, in einen Kolben oder ein Reagenzglas. Wenn Sie in reinen Sauerstoff angezündete anzünden, dann brennt er heller, als in der Luft. Die beiden anderen Labor-Verfahren zur Herstellung von Sauerstoff - Zersetzung von Wasserstoffperoxid und Kaliumchlorat (bertoletovoy Salz). Betrachten Sie die Schaltung des Gerätes, die verwendet wird für die thermische Zersetzung.
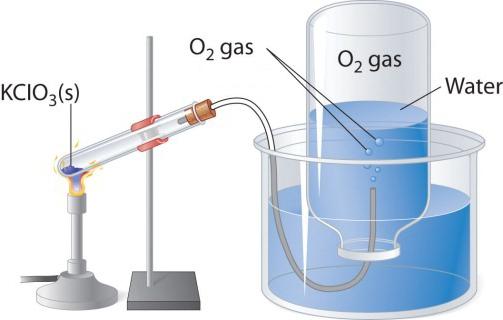
In ein Reagenzglas oder Rundkolben notwendig, Gießen Sie ein wenig bertoletovoy Salz, schließen Sie den Deckel mit газоотводной Trinkhalm. Sie sollte an das gegenüberliegende Ende (unter Wasser) in der umgeworfene Kolben auf den Kopf. Der Hals sollte unten in eine große Tasse oder Kokille, gefüllt mit Wasser. Reagenzgläser beim erhitzen mit bertoletovoy Salz Sauerstoff freigesetzt. Nach einer auspufftube er kommt in den Kolben, verdrängt Sie das Wasser aus. Wenn der Kolben Gas gefüllt, schließen Sie unter Wasser Rohr und umgedreht. Die in diesem Labor Erfahrung Sauerstoff können für das Studium der chemischen Eigenschaften der einfachen Stoffe.
Brennen
Wenn im Labor erfolgt die Verbrennung von Stoffen in Sauerstoff, was Sie wissen müssen und die Brandschutzregeln achten. Wasserstoff sofort verbrennt in der Luft, gemischt mit Sauerstoff im Verhältnis 2:1, er ist explosiv. Die Verbrennung der Stoffe in reinem Sauerstoff ist viel intensiver als in der Luft. Erklärt wird dieses Phänomen Zusammensetzung der Luft. Sauerstoff in der Atmosphäre beträgt etwas mehr als 1/5 der Teile (21%). Brennen " ist die Reaktion von Stoffen mit Sauerstoff, in Folge dessen bilden sich verschiedene Produkte, vor allem die Oxide von Metallen und Nichtmetallen. Feuergefährdet Mischung Über2 mit brennbaren Stoffen, darüber hinaus, die daraus resultierenden verbindungen können toxisch sein.
Normale Kerze Brennen (oder Streichhölzer) durch die Bildung von Kohlendioxid. Die folgende Erfahrung kann zu Hause durchgeführt werden. Wenn verbrennen Substanz unter Glas oder einer großen Tasse, dann die Verbrennung wird gestoppt, sobald der gesamte Sauerstoff aufgebraucht ist. Stickstoff unterstützt die Atmung und Verbrennung. Kohlendioxid ä Produkt der Oxidation " nicht mehr reagiert mit dem Sauerstoff. Transparente kalkhaltigem Wasser können Sie das Vorhandensein von Kohlendioxid nach der Verbrennung der Kerze. Wenn das überspringen der Verbrennungsprodukte durch Calciumhydroxid, dann wird die Lösung trübe. Eine Chemische Reaktion zwischen dem kalkigen Wasser und Kohlendioxid, entsteht der unlösliche Calciumcarbonat.

Erste Sauerstoff im industriellen Maßstab
Die billigste Prozess, infolge dessen ergeben sich die freie Moleküle aus der Luft Über2, nicht verbunden mit der Durchführung von chemischen Reaktionen. In der Industrie, sagen wir, die Stahlwerke, die Luft bei niedriger Temperatur und hohem Druck сжижают. Die wesentlichen Komponenten der Atmosphäre, wie Stickstoff und Sauerstoff, sieden bei unterschiedlichen Temperaturen. Teilen Luftgemisch durch allmähliches erhitzen auf eine normale Temperatur. Zunächst zeichnen sich die Moleküle von Stickstoff, dann mit Sauerstoff. Verfahren zur Trennung beruht auf unterschiedlichen physikalischen Eigenschaften der einfachen Stoffe. Die Formel der einfachen Substanz Sauerstoff ist die gleiche wie vor dem abkühlen und verflüssigen von Luft ü Ber2.
In der Folge einige Reaktionen Elektrolyse auch Sauerstoff freigesetzt, es wird über der entsprechenden Elektrode. Gas braucht einen Industrie -, Bau-Unternehmen in großen Mengen. Sauerstoffbedarf ständig wachsen, vor allem braucht es die Chemische Industrie. Das entstehende Gas speichern für die Industrie und medizinische Zwecke in Stahlflaschen, die mit der Markierung. Behälter mit Sauerstoff färben in blau oder Blaue Farbe zur Unterscheidung von anderen verflüssigte Gase ä Stickstoff, Methan, Ammoniak.

Chemische Berechnungen nach der Formel Gleichungen und Reaktionen, bei denen Moleküle Über2
Zahlenwert der Molaren Masse von Sauerstoff ist identisch mit einer anderen Größe ä einer relativen Molekülmasse. Nur im ersten Fall sind die Einheiten. Kurz die Formel der Substanz Sauerstoff und seine molare Masse muß so geschrieben werden: M(O2) = 32 G/mol. Unter normalen Bedingungen beteirgendein Gas entspricht einem Volumen von 22,4 L. Also 1 mol Über2 — es ist 22,4 L Stoffe, 2 mol Über die2 — 44,8 L. Durch die Gleichung der Reaktion zwischen Sauerstoff und Wasserstoff werden Sie feststellen, dass die Interaktion 2 mol Wasserstoff und 1 mol Sauerstoff:
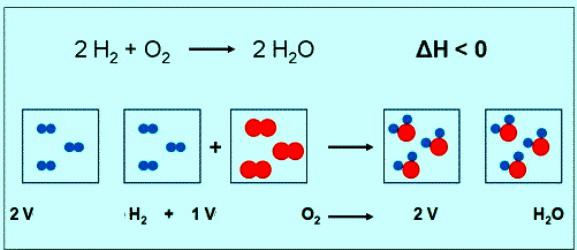
Wenn in der Reaktion beteiligt ist 1 mol Wasserstoff, das Volumen an Sauerstoff beträgt 0,5 mol • 22,4 L/mol = 11,2 L.
Die Rolle von Molekülen Über2 in der Natur und des menschlichen Lebens
Sauerstoff verbraucht lebenden Organismen auf der Erde beteiligt und im Kreislauf der Stoffe von mehr als 3 Milliarden Jahren. Dies ist die wichtigste Substanz für die Atmung und den Stoffwechsel, Zersetzung von Molekülen von Nährstoffen, synthetisiert die notwendige Energie für Organismen. Sauerstoff ständig verausgabt sich auf der Erde, aber seine Vorräte ergänzt durch Fotosynthese. Russische Wissenschaftler K. Тимирязев glaubte, dass gerade durch diesen Prozess bis dahin gibt es Leben auf unserem Planeten.

Die Rolle des Sauerstoffes in der Natur und Landwirtschaft:
- Absorbiert in den Prozess der Atmung von lebenden Organismen;
- Nimmt an den Reaktionen der Photosynthese in Pflanzen;
- Im Lieferumfang von organischen Molekülen;
- Prozesse der Fäulnis, Gärung, Rost verlaufen unter Beteiligung von Sauerstoff als das Oxidationsmittel;
- Wird benutzt, um die wertvollen Produkte der organischen Synthese.
Das Verflüssigte Sauerstoff in Druckgasflaschen verwenden zum schneiden und Schweißen von Metallen bei hohen Temperaturen. Diese Prozesse werden in technischen Anlagen, Transport-und Bau-Unternehmen. Für die Durchführung der arbeiten unter Wasser, unter der Erde, in großer Höhe im luftleeren Raum Menschen brauchen auch in den Molekülen Über2. Sauerstoff-Kissen werden in der Medizin zur Anreicherung der Zusammensetzung der Luft, eingeatmet Kranken Menschen. Gas für medizinische Zwecke unterscheidet sich von der technischen fast vollständige fehlen von Verunreinigungen, Geruch.

Sauerstoff ä perfekte Oxidationsmittel
Bekannt ist die Verbindung des Sauerstoffes mit allen chemischen Elementen des Periodensystems außer den ersten Vertreter der Familie der Edelgase. Viele Stoffe kommen direkt in Reaktionen mit den Atomen Über, ohne Halogene, Gold und Platin. Von großer Bedeutung sind Phänomene mit Beteiligung von Sauerstoff, die durch die Freisetzung von Licht und Wärme. Solche Prozesse sind weit verbreitet in Haushalten, der Industrie. In der Metallurgie Interaktion Erzen mit Sauerstoff nennt man rösten. Vorher zerkleinertes Erz vermischt mit Luft, angereichertem Sauerstoff. Bei hohen Temperaturen erfolgt die Wiederherstellung von Metallen aus Sulfiden bis hin zu einfachen Stoffen. So bekommen die Eisen und einige ne-Metalle. Die Präsenz von reinem Sauerstoff erhöht die Geschwindigkeit der technologischen Prozesse in verschiedenen Branchen Chemie, Technologie und Metallurgie.
Die Entstehung des Billigen Verfahrens zur Herstellung von Sauerstoff aus der Luft mit dieser Methode Entbündelung bei niedrigen Temperaturen stimuliert die Entwicklung vieler Richtungen der industriellen Produktion. Chemiker betrachten die Moleküle Über2 Und die Atome Über die idealen oxidierenden Agenzien. Dies sind die natürlichen Materialien, Sie wird ständig fortgesetzt in der Natur, nicht die Umwelt verschmutzen. Darüber hinaus Chemische Reaktionen unter Beteiligung von Sauerstoff meistens enden die Synthese eines natürlichen und sicheren Produkt - ä Wasser. Über die Rolle der2 bei der Entfernung von toxischen Abfällen, Reinigung des Wassers von Verunreinigungen. Neben Sauerstoff, zur Desinfektion wird es аллотропная Modifikation ä Ozon. Diese einfache Substanz hat eine hohe oxidative Aktivität. Bei der Ozonisierung des Wassers zersetzen Schadstoffe. Ozon auch nachteilige Wirkung auf болезнетворную Mikroflora.
Article in other languages:
KK: https://tostpost.com/kk/b-l-m/20346-formulasy-otteg-mendeleevt-periodty-kestes---otteg.html
PL: https://tostpost.com/pl/edukacja/20321-formu-a-tlenu-uk-ad-okresowy-mendelejewa---tlen.html
TR: https://tostpost.com/tr/e-itim/20355-form-l-oksijen-periyodik-tablo-periyodik---oksijen.html
UK: https://tostpost.com/uk/osv-ta/20338-formula-kisnyu-per-odichna-tablicya-mendel-va---kisen.html

Alin Trodden - autor des Artikels, Herausgeber
"Hi, ich bin Alin Trodden. Ich schreibe Texte, lese Bücher und suche nach Eindrücken. Und ich bin nicht schlecht darin, dir davon zu erzählen. Ich freue mich immer, an interessanten Projekten teilzunehmen."
Verwandte News
Harun AR-Rashid: Ziele, Erfolge, Gegner. Der Vorstand Harun AR-Raschid
die Zweite Hälfte des 8. Jahrhunderts N. Chr. war die Schwächung der Zentralgewalt und die Randgebiete des Kalifats erhielten neue Impulse. Vor dem hintergrund der Allgemeinen Veränderungen besonders auffiel Bagdad. Ziemlich schne...
Hohe Mittelalter: Kunst und Kultur
Hochmittelalter - einer der bestimmenden Perioden in der Geschichte der Menschheit. In jenen Fernen und dunklen Zeiten entwickelte sich die moderne Zivilisation. Verschwanden die alten Fundamente und gab es neue. Deutlich erhöht d...
Bestechung ist unsere Vergangenheit oder Gegenwart?
Heute sprechen wir über das obsolete Wort, das vor langer Zeit schon verlassen Alltags eines gewöhnlichen Menschen. Die Zeit geht voran und viele Worte werden архаизмами, die nicht Fuß fassen in der neuen Umgebung. Das komische is...
Sumy State University: Adresse, Fakultäten, Fachrichtung
Sumy State University – dies ist eine der Hochschulen der Ukraine. Die HOCHSCHULE hat eine ziemlich hohe Position in den internationalen Rankings. Befindet sich die Universität in Sumy (die Stadt ist hauptsächlich in der Geg...
Personen: Taxonomie und charakteristische Merkmale in der Struktur des Körpers
einen Besonderen Platz im System der organischen Welt durch einen Mann. Taxonomie dieser Spezies hat seine eigenen Besonderheiten. Verbunden sind Sie mit биосоциальной Grundlage des Homo sapiens.Person: Taxonomieeinerseits ist der...
Die Schrift "Mein Lieblingslehrer" für Schüler
In der Schule den Schülern oft den Auftrag geben, einen Aufsatz zu schreiben zu verschiedenen Themen. Eine solche kreative Aufgabe ist interessant und bietet die Möglichkeit, in vollem Umfang die Phantasie zu zeigen und zu erzähle...





















Kommentare (0)
Dieser Artikel wurde noch kein Kommentar abgegeben, sei der erste!