Хімічныя ўласцівасці этыленгліколю, характарыстыка. Двухатомный спірт. Эфіры этыленгліколю
Самыя вядомыя і прымяняюцца ў жыцці чалавека і ў прамысловасці рэчывы, якія належаць да катэгорыі многоатомных спіртоў – гэта этыленгліколю і гліцэрына. Іх даследаванне і выкарыстанне пачалося некалькі стагоддзяў таму, але ўласцівасці гэтых арганічных злучэнняў шмат у чым непаўторныя і ўнікальныя, што робіць іх незаменнымі і па гэты дзень. Многоатомные спірты выкарыстоўваюць у многіх хімічных синтезах, галінах прамысловасці і сферах чалавечай жыццядзейнасці.
Першае «знаёмства» з этиленгликолем і гліцэрынай: гісторыя атрымання
У 1859 годзе, з дапамогай двухстадийного працэсу ўзаемадзеяння дибромэтана з ацэтат срэбра і наступнай апрацоўкі з'едлівым гартуй атрыманага ў першай рэакцыі этиленгликольдиацетата, Шарль Вюрц ўпершыню сінтэзаваў этыленгліколю. Некаторы час праз быў распрацаваны метад прамога гідролізу дибромэтана, але ў прамысловых маштабах ў пачатку дваццатага стагоддзя двухатомный спірту 1,2-диоксиэтан, ён жа – моноэтиленгликоль, або проста гліколь, у ЗША атрымлівалі з дапамогай гідролізу этиленхлоргидрина.
На сённяшні дзень і ў прамысловасці, і ў лабараторыі ўжываюць шэраг іншых метадаў, новых, больш эканамічных з сыравіннай і энергетычнай кропак гледжання, і экалагічных, так як прымяненне рэагентаў, якія змяшчаюць або якія вылучаюць хлор, таксіны, канцерогены і іншыя небяспечныя для навакольнага асяроддзя і чалавека рэчывы, скарачаецца па меры развіцця «зялёнай» хіміі.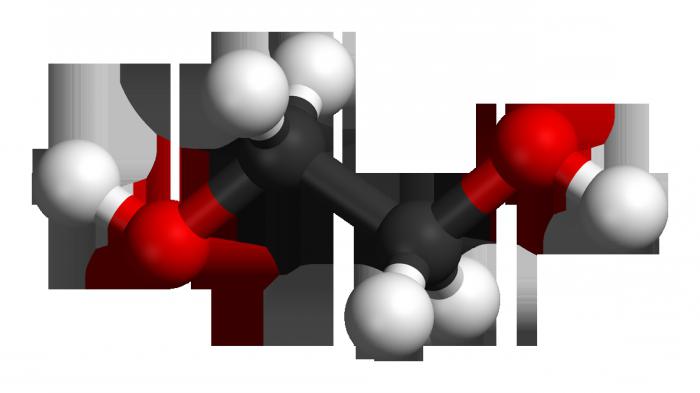
Аптэкарам Карлам Вільгельмам Шэель ў 1779 годзе быў адкрыты гліцэрына, а асаблівасці складу злучэння вывучыў у 1836 годзе Тэафіль Жуль Пелуз. Двума дзесяцігоддзямі пазней было ўстаноўлена і абгрунтавана будова малекулы дадзенага трехатомного спірту ў працах П'ера Эжэна Марселея Круціла і Шарля Вюрца. Нарэшце, яшчэ дваццаць гадоў праз Шарль Фридель правёў поўны сінтэз гліцэрыны. У цяперашні час прамысловасць выкарыстоўвае два метаду яе атрымання: праз хлорысты аллил з прапілену, а таксама праз акролеин. Хімічныя ўласцівасці этиленгиликоля, як і гліцэрыны, шырока выкарыстоўваюць у розных сферах хімічнай вытворчасці.
Больш:
Нервовы імпульс, яго пераўтварэнне і механізм перадачы
Нервовая сістэма чалавека выступае своеасаблівым каардынатарам у нашым арганізме. Яна перадае каманды ад мозгу мускулатуры, органаў, тканін і апрацоўвае сігналы, якія ідуць ад іх. У якасці своеасаблівага носьбіта дадзеных выкарыстоўваецца нервовы імп...
Куды паступаць пасля 11 класа? Якую выбраць прафесію?
Пры выбары сваёй будучай прафесіі не варта абапірацца на чые-то рэкамендацыі і парады, тым больш не трэба падпарадкоўвацца сваім бацькам, якія даволі часта вырашаюць без вас самастойна, куды паступіць пасля 11 класа. Варта задумацца, наколькі паспяхо...
Крывяносная сістэма жывёл, як вынік эвалюцыйнага развіцця свету
Крывяносная сістэма жывёл прайшла доўгі шлях фарміравання ў ходзе эвалюцыйнага развіцця свету. Яна ўтварылася на месцы рудыментарных частак першаснай паражніны цела, якая ў вышэйшых жывёл была выцесненая целломом, або другаснай паражніной цела. У пра...
Будова і структура злучэння
У аснове малекулы ляжыць непредельный вуглевадародны шкілет этылену, які складаецца з двух атамаў карбону, у якім адбыўся разрыў двайны сувязі. На вызваліліся валентныя месца ў атамаў вугляроду далучыліся дзве гідраксільная групы. Формула этылену – З2Н4, пасля разрыву кранной сувязі і далучэння гідраксільных груп (праз некалькі стадый) яна выглядае як З2Н4(ЁН)2. Гэта і ёсць этыленгліколю.
Малекуле этылену ўласцівая лінейная структура, у той час як двухатомный спірт мае нейкае падабенства транс-конфигурции ў размяшчэнні гідраксільных груп па адносінах да углеродному остову і адзін да аднаго (у поўнай меры гэты тэрмін выкарыстоўваецца і ў дачыненні да становішча адносна кратнай сувязі). Такая дыслакацыя адпавядае самому выдаленага размяшчэнню водородов з функцыянальных груп, меншай энергіі, а значыць – максімальнай ўстойлівасці сістэмы. Папросту кажучы, адна ЁН-група «глядзіць» ўверх, а іншая - уніз. У той жа час з'яўляюцца няўстойлівымі злучэння з двума гидроксилами: пры адным атаме карбону, образуясь ў рэакцыйнай сумесі, яны тут жа дегидратируются, пераходзячы ў альдэгіды.
Класіфікацыйная прыналежнасць
Хімічныя ўласцівасці этыленгліколю вызначаюцца яго паходжаннем з групы многоатомных спіртоў, а менавіта падгрупы диолов, то ёсць злучэнняў з двума гідраксільная фрагментамі ў суседніх атамаў карбону. Рэчывам, таксама якія змяшчаюць некалькі ЁН-намеснікаў, з'яўляецца і гліцэрына. Ён мае тры спіртавых функцыянальных групы і з'яўляецца самым распаўсюджаным прадстаўніком свайго падкласа.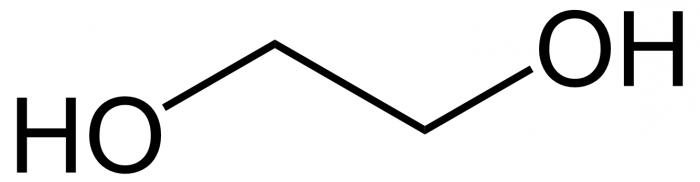
Многія злучэнні гэтага класа таксама атрымліваюць і выкарыстоўваюць у хімічным вытворчасці для розных синтезов і іншых мэтаў, але прымяненне этыленгліколю мае больш сур'ёзныя маштабы і задзейнічана практычна ва ўсіх галінах прамысловасці. Гэтае пытанне будзе разгледжана ніжэй больш падрабязна.
Фізічныя характарыстыкі
Прымяненне этыленгліколю тлумачыцца наяўнасцю шэрагу уласцівасцяў, якія ўласцівыя многоатомным спірту. Гэта адметныя рысы, характэрныя толькі для дадзенага класа арганічных злучэнняў.
Самае важна з уласцівасцяў – гэта неабмежаваная здольнасць змешвацца з Н2А. Вада + этыленгліколю дае раствор, які валодае унікальнай характарыстыкай: тэмпература яго замярзання, у залежнасці ад канцэнтрацыі диола, ніжэй на 70 градусаў, чым у чыстага дыстыляту. Важна адзначыць, што залежнасць гэтая нелінейная, і па дасягненні пэўнага колькаснага ўтрымання гліколь пачынаецца зваротны эфект – тэмпература замярзання павышаецца пры павелічэнні працэнтнага ўтрымання растворяемого рэчывы. Гэтая асаблівасць знайшла прымяненне ў галіне вытворчасці розных антыфрызаў, вадкасцяў «незамерзаек», якія крышталізуюцца пры вельмі нізкіх тэрмічных характарыстыках навакольнага асяроддзя.
Акрамя як у вадзе, працэс растварэння выдатна працякае ў спірце і ацэтоне, але не назіраецца ў парафинах, бензолах, эфірах і тетрахлорметане. У адрозненне ад свайго перадаюцца праз ваду пу родапачынальніка - такога газападобнага рэчывы, як этылен, этыленгліколю – гэта сиропоподобная,празрыстая, з нязначным жоўтым адценнемвадкасць, саладкавы па гусце, з нехарактэрным пахам, практычна нелетучая. Замярзанне стопрацэнтнага этыленгліколю адбываецца пры - 12,6 градусах Цэльсія, а кіпенне – пры +197,8. У нармальных умовах шчыльнасць складае 1,11 г/см3.
Метады атрымання
Этыленгліколю можна атрымаць некалькімі спосабамі, некаторыя з іх сёння маюць толькі гістарычнае або препаративное значэнне, а іншыя актыўна выкарыстоўваюцца чалавекам у прамысловых маштабах і не толькі. Ідучы ў храналагічным парадку, разгледзім самыя важныя.
Вышэй ужо быў апісаны першы метад атрымання этыленгліколю з дибромэтана. Формула этылену, падвойная сувязь якога разарваная, а свабодныя валентнасці занятыя галагенных, - галоўнага зыходнага рэчывы ў дадзенай рэакцыі - акрамя вугляроду і вадароду мае ў сваім складзе два атама брому. Адукацыя прамежкавага злучэння на першай прыступкі працэсу, магчыма, як раз дзякуючы іх отщеплению, г. зн. замяшчэнню ацетатными групамі, якія пры далейшым гідроліз ператвараюцца ў спіртавыя.
У працэсе далейшага развіцця навукі стала магчымым атрыманне этыленгліколю прамым гідролізам любых этанов, замешчаных двума галагенных ў суседніх атамаў карбону, з дапамогай водных раствораў карбанатаў металаў з шчолачны групы ці (менш экалагічны рэагент) Н2Аб і дыяксіду свінцу. Рэакцыя даволі «працаёмкая» і працякае толькі пры значна падвышаных тэмпературах і ціску, але гэта не перашкодзіла немцам у перыяды сусветных войнаў выкарыстоўваць гэты метад для вытворчасці этыленгліколю ў прамысловых маштабах.
Сваю ролю ў станаўленні арганічнай хіміі адыграў і спосаб атрымання этыленгліколю з этиленхлоргидрина шляхам яго гідролізу вугальнымі солямі металаў шчолачны групы. Пры павышэнні тэмпературы рэакцыі да 170 градусаў выхад мэтавага прадукту дасягаў 90 %. Але быў значны недахоп – гліколь трэба было як-то здабываць з раствора солі, што непасрэдна спалучана з шэрагам цяжкасцяў. Навукоўцы вырашылі гэтае пытанне, распрацаваўшы метад з тым жа зыходным рэчывам, але разбіўшы працэс на дзве стадыі.
Гідроліз этиленгликольацетатов, з'яўляючыся раней завяршальнай стадыяй метаду Вюрца, стаў асобным спосабам, калі здолелі атрымаць зыходны рэагент акісленнем этылену ў воцатнай кіслаце кіслародам, гэта значыць без прымянення дарагіх і зусім неэкалагічна злучэнняў галагенаў.
Вядома таксама шмат спосабаў вытворчасці этыленгліколю шляхам акіслення этылену гидроперекисями, перекисями, арганічнымі надкислотами ў прысутнасці каталізатараў (злучэнняў осмия), хлоратом калія і інш. Таксама існуюць электрахімічнай і радыяцыйна-хімічныя метады.
Характарыстыка агульных хімічных уласцівасцяў
Хімічныя ўласцівасці этыленгліколю вызначаюцца яго функцыянальнымі групамі. У рэакцыях можа прымаць удзел адзін гидроксильный намеснік або абодва, у залежнасці ад умоў працэсу. Галоўнае адрозненне ў рэакцыйнай здольнасці заключаецца ў тым, што за кошт наяўнасці ў многоатомного спірту некалькіх гидроксилов і іх узаемнага ўплыву выяўляюцца больш моцныя кіслотныя ўласцівасці, чым у одноатомных "субратаў". Таму ў рэакцыях са шчолачамі прадуктамі з'яўляюцца солі (для гліколь – гликоляты, для гліцэрыны – глицераты).
У хімічныя ўласцівасці этыленгліколю, роўна як і гліцэрыны, ўваходзяць усе рэакцыі спіртоў з катэгорыі одноатомных. Гліколь дае поўныя і няпоўныя эфіры ў рэакцыях з одноосновными кіслотамі, гликоляты, адпаведна, утворацца з шчолачнымі металамі, а пры хімічным працэсе з моцнымі кіслотамі або іх солямі вылучаецца альдэгіды воцатнай кіслаты - за кошт адшчапленнем ад малекулы атама вадароду.
Рэакцыі з актыўнымі металамі
Узаемадзеянне этыленгліколю з актыўнымі металамі (якія стаяць пасля вадароду ў хімічным шэрагу напружанасці) пры падвышаных тэмпературах дае этиленгликолят адпаведнага металу, плюс вылучаецца вадарод.
З2Н4(ЁН)2 + Х → З2Н4Аб2Х, дзе Х – актыўны двухвалентный метал.
Якасная рэакцыя на этыленгліколю
Адрозніць многоатомные спірт ад любой іншай вадкасці можна з дапамогай нагляднай рэакцыі, характэрнай толькі для дадзенага класа злучэнняў. Для гэтага да бесцветному раствора спірту ўліваюць свежеосажденный гідраксід медзі (2), які мае характэрны блакітны адценне. Пры ўзаемадзеянні змешаных кампанентаў назіраецца растварэнне асадка і афарбоўванне раствора ў насычана сіні колер - у выніку адукацыі гликолята медзі (2).
Полімерызацыі
Хімічныя ўласцівасці этыленгліколю маюць вялікае значэнне для вытворчасці растваральнікаў. Межмолекулярная дэгідратацыя згаданага рэчыва, то ёсць отщепление вады ад кожнай з дзвюх малекул гліколь і іх наступнае аб'яднанне (адна гідраксільная група отщепляется цалкам, а ад іншай адыходзіць толькі вадарод), дае магчымасць атрымання унікальнага арганічнага растваральніка – диоксана, які часта выкарыстоўваецца ў арганічнай хіміі, нягледзячы на яго высокую таксічнасць.
Абмен гидроксила на галаген
Пры ўзаемадзеянні этыленгліколю з галогеноводородными кіслотамі назіраецца замена гідраксільных груп адпаведным галагенавымі. Ступень замяшчэння залежыць ад мольн канцэнтрацыі ў галогенводородарэакцыйнай сумесі:
АЛЕ-СН2-СН2-ЁН + 2НХ → Х-СН2-СН2-Х, дзе Х – хлор або бром.
Атрыманне эфіраў
У рэакцыях этыленгліколю з азотнай кіслатой (пэўнай канцэнтрацыі) і одноосновными арганічнымі кіслотамі (мурашынай, воцатнай, пропионовой, масленым, валерьяновой і г. д.) адбываецца адукацыя складаных і, адпаведна, простых моноэфиров. Пры іншых канцэнтрацыя азотнай кіслаты – ды - і тринитроэфиров гліколь. У якасці каталізатара выкарыстоўваецца серная кіслата зададзенай канцэнтрацыі.
Найважнейшыя вытворныя этыленгліколю
Каштоўнымі рэчывамі, якія можна атрымаць з многоатомных спіртоў з дапамогай нескладаных хімічных рэакцый (апісаных вышэй), з'яўляюцца эфіры этыленгліколю. А менавіта: монометиловый і моноэтиловый, формулы якіх - АЛЕ-СН2-СН2-О-СН3 АЛЕ-СН2-СН2-О-З2Н5 адпаведна. Па хімічныя ўласцівасці яны шмат у чым падобныя на гліколі, але, гэтак жа, як і любы іншы клас злучэнняў, маюць унікальныя рэакцыйныя асаблівасці, уласцівыя толькі ім:
- Монометилэтиленгликоль ўяўляе сабой вадкасць без колеру, але з характэрным гідкае пахам, закипающую пры 124,6 градусах Цэльсія, выдатна растворяющуюся ў этаноле і іншых арганічных растваральніках і ў вадзе, значна больш лятучую, чым гліколь, і з шчыльнасцю меншай, чым у вады (парадку 0,965 г/см3).
- Диметилэтиленгликоль – таксама вадкасць, але з менш характэрным пахам, шчыльнасцю 0,935 г/см3, тэмпературай закіпання 134 градуса вышэй за нуль і растваральнасцю, параўнальнай з папярэднім гомологом.
Ужыванне целлозольвов - так увогуле называюць моноэфиры этыленгліколю - даволі распаўсюджана. Яны выкарыстоўваюцца ў якасці рэагентаў і растваральнікаў ў арганічным сінтэзе. Таксама ўжываюцца і іх фізічныя ўласцівасці для антыкаразійным і антикристаллизационных дабавак у антыфрызы і маторныя масла.
Вобласці прымянення і коштавая палітыка прадукцыйнага шэрагу
Кошт на заводах і прадпрыемствах, якія займаюцца вытворчасцю і продажам падобных рэактываў, вагаецца ў сярэднім каля 100 рублёў за кілаграм такога хімічнага злучэння, як этыленгліколю. Кошт залежыць ад чысціні рэчывы і максімальнага працэнтнага ўтрымання мэтавага прадукту.
Прымяненне этыленгліколю не абмяжоўваецца якой-то адной вобласцю. Так, у якасці сыравіны яго выкарыстоўваюць у вытворчасці арганічных растваральнікаў, штучных смол і валокнаў, вадкасцяў, тых, хто замярзае пры адмоўных тэмпературах. Ён задзейнічаны ў многіх прамысловых галінах, такіх як аўтамабільная, авіяцыйная, фармацэўтычная, электратэхнічная, гарбарная, тытунёвая. Бясспрэчна важка яго значэнне для арганічнага сінтэзу.
Важна памятаць, што гліколь – гэта таксічнае злучэнне, якое можа нанесці непапраўную шкоду здароўю чалавека. Таму яго захоўваюць у герметычных сасудах з алюмінія або сталі з абавязковым унутраным пластом, якія абараняюць ёмістасць ад карозіі, толькі ў вертыкальных палажэннях і памяшканнях, не забяспечаных ацяпляльнымі сістэмамі, але з добрай вентыляцыяй. Тэрмін – не больш за пяць гадоў.
Article in other languages:

Alin Trodden - аўтар артыкула, рэдактар
"Прывітанне, Я Алін Тродден. Я пішу тэксты, чытаю кнігі і шукаю ўражанні. І я нядрэнна ўмею распавядаць вам пра гэта. Я заўсёды рады ўдзельнічаць у цікавых праектах."
Навіны
Адрозненні і падабенства жывёлы і чалавека: ўнутраныя органы, знешні выгляд, зносіны, адносіны
Падабенства і адрозненні чалавека і жывёлы - вельмі цікавая тэма. Пасля таго, як Ч. Дарвін стварыў сваю эвалюцыйную тэорыю, пачаліся бясконцыя спрэчкі наконт таго, ці сапраўды людзі адбыліся ад малпаў або жа з'явіліся нейкім іншым...
Якім быў Аляксандр 2? Асобу імператара. Біяграфія, гады праўлення
Першы вясновы дзень 1881 года быў обагрен крывёю імператара, які ўвайшоў у гісторыю Расіі як вялікі правадыр рэформаў, па праве заслужыў падараваны яму народам эпітэт вызваліцеля. У гэты дзень імператар Аляксандр 2 (гады праўлення...
Характарыстыка герояў. «Гранатавы бранзалет» Купрына
Герой аповесці «Гранатавы бранзалет» – адзін з самых кранальных вобразаў у літаратуры. Над рукапісам гэтага твора плакаў сам аўтар. Купрын сцвярджаў, што яно з'яўляецца самым цнатлівым з усяго таго, што ён ствары...
Лазеры паўправадніковыя: віды, прылада, прынцып працы, прымяненне
Паўправадніковыя лазеры з'яўляюцца квантавымі генератарамі на аснове паўправадніковай актыўнай асяроддзя, у якой аптычнае ўзмацненне ствараецца вымушаным выпраменьваннем пры квантавым пераходзе паміж энергетычнымі ўзроўнямі пры вя...
Як звязаны дзейнасць і патрэбы чалавека? Патрэба, дзейнасць, матыў дзейнасці
Аб тым, як звязаны дзейнасць і патрэбы, сказана нямала. Ёсць цэлыя навуковыя працы, прысвечаныя дадзенай тэме. Яна сапраўды вельмі цікавая і разнастайная. Усю яе абмеркаваць складана, бо сутнасць тычыцца самога непазнанага істоты ...
Першая ў свеце канстытуцыя: ад Спарты да ЗША
Дзе з'явілася першая канстытуцыя? На гэтае пытанне паспрабуем адказаць у дадзеным артыкуле. Але спачатку разбярэм паняцце.Канстытуцыя ў сучасным значэнніПершая ў свеце канстытуцыя ў сучасным значэнні з'явілася ў ЗША. Пад дадзеным ...





















Заўвага (0)
Гэтая артыкул не мае каментароў, будзьце першым!